Digitale Qualitätsmanagementsoftware (QMS) für die Medizintechnik
Jeder Aspekt des medizintechnischen Prozesses muss gemäß den Anforderungen der ISO 13845 und der US FDA QSR für Medizinprodukteunternehmen kontrolliert und überwacht werden. Um die Integrität des Unternehmens zu gewährleisten und die Qualitätssicherung aufrechtzuerhalten, ist die Einführung zusätzlicher Normen wie ISO 9000 anzustreben. Das bedeutet, dass effiziente Prozesse im gesamten Unternehmen, von der Produktentwicklung über die Lieferkette bis hin zum Versand, installiert werden müssen. Durch die Einführung einer starken, prozessorientierten Kultur kann Ihr Unternehmen reibungslos von chaotischen und Ad-hoc-Managementsystemen zu einem reibungslosen Betrieb übergehen, der den Gewinn steigert.
Zum Qualitätsmanagementsystem für Medizinprodukte (QMS)
Ein Qualitätsmanagementsystem für Medizinprodukte beinhaltet eine strukturierte Zusammenstellung von Prozessen und Verfahren, die alle Aspekte der Entwicklung, Lagerung, klinischen Daten, Lieferantenmanagement, Risikomanagement, Herstellung, Bearbeitung von Reklamationen, Produktkennzeichnung, Vertrieb und vieles mehr umfassen.
Die meisten Medizinprodukte benötigen ab einem bestimmten Zeitpunkt irgendeine Form von QMS, wobei die Komplexität des QMS von Gerät zu Gerät je nach Klassifizierung variiert. Stellt ein Unternehmen beispielsweise ein Produkt der Klasse II (mittleres Risiko) oder der Klasse III (hohes Risiko) her, so benötigt es ein anderes QMS als ein Unternehmen der Klasse I (geringes Risiko), das nicht wiederverwendbare, nicht sterile, nicht messende chirurgische Instrumente herstellt.
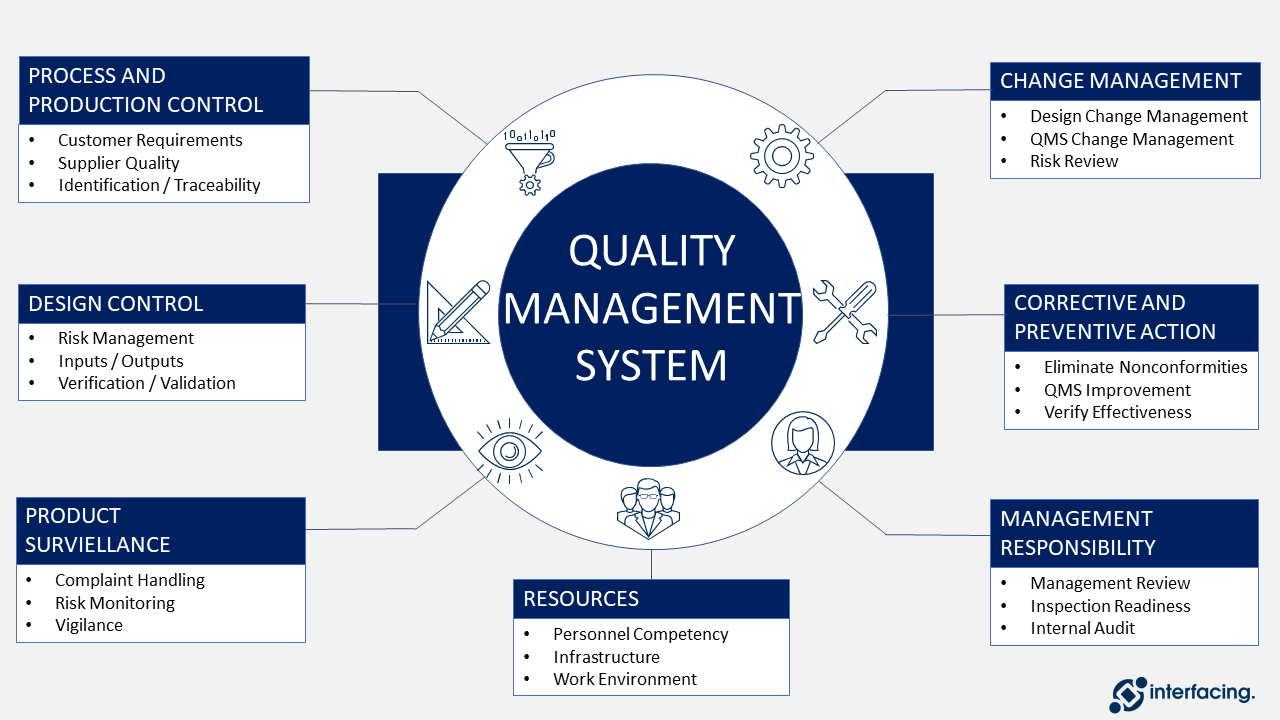
Klicken Sie auf das Bild unten, um eine Grundstruktur des QMS zu sehen.
Eine auf die Bedürfnisse der Medizintechnikbranche zugeschnittene Lösung
Große Lifescience Unternehmen haben sich mit Interfacing zusammengeschlossen, um Workflow-Lösungen für die Verwaltung und Automatisierung von Punkt-zu-Punkt-Geschäftsprozessen zu implementieren. Dazu gehören Labor-, Herstellungs-, Verwaltungs-, Produkt- und patientenbezogene Prozesse.
Interfacings Lösung zur Prozessoptimierung und -automatisierung, zur Digitalisierung der SOP-Dokumentation und zur proaktiven Überwachung von Vorschriften, die Enterprise Process Center© Suite, hat durch beschleunigte Genehmigungs- und Validierungsprozesse, verbesserte Transparenz und operative Verbesserungen zu erheblichen Zeiteinsparungen bei Kunden wie den folgenden geführt:
End-to-End Übereinstimmung- Die einzige Quelle der Wahrheit
Mit dem EPC können Lifescience Unternehmen Abteilungen, Regeln, Verfahren und Kontrollen in einem einzigen Repository zusammenführen, um schnelle und standardisierte kontinuierliche Verbesserungen zu ermöglichen. Unsere Technologie ermöglicht die Fragmentierung von Informationen, um wiederverwendbare Datenfragmente zu erstellen.
Beschleunigte Genehmigungen und Validierung
Die Anbindung der QMS-Lösung führt zu einer nachhaltigen Zeitersparnis durch geringeren Zeitaufwand für Schulungen, Aktualisierungen und Nachschulungen. Der integrierte Genehmigungs-, Review- und Freigabe-Workflow trägt auch dazu bei, die Validierung neuer Versionen von Standardarbeitsanweisungen (SOPs) zu rationalisieren und die Entscheidungsfindung zu erleichtern.
Digitale Signatur und Multifaktor-Authentifizierung
EPC erfüllt die strengen Anforderungen von FSA QSR, ISO 13845 und GxP-Programmen. Alle SOPs und Prozesse werden analysiert und mit Prüfprotokollen dokumentiert, die 21 CFR Part 11 Electronic Record and Electronic Signature (ERES) und eine Vielzahl anderer gesetzlicher Anforderungen durch RSA-Verschlüsselung, Tresorschlüsselhistorie und Multi-Faktor-Authentifizierung (MFA) erfüllen.
Verbesserung von Geschwindigkeit und Agilität
Die Enterprise Process Center© Suite von Interfacing ist vollständig mobil und digital und bietet Lifescience Unternehmen die Flexibilität einer Qualitätsdokumentation, die über eine Vielzahl von Medien wie Telefon, Tablet, Grafik und Text zugänglich ist, um die Agilität und das Selbststudium der Mitarbeiter zu fördern.
Mehrsprachige Unterstützung, automatische Übersetzung und lokalisierte Inhalte
Die Enterprise Process Center© Suite von Interfacing bietet aufschlussreiche Möglichkeiten für das Management globaler Inhalte, sei es durch automatische Übersetzungsvorschläge für alle Inhaltsfragmente oder die Möglichkeit, Abweichungen für SOPs nach Land, Region oder Produkttyp zu sammeln.
Unternehmen aus den Bereichen Life Sciences und Medizintechnik vertrauen auf Interfacing als erstklassige Lösung für das Management ihrer hochwertigen Inhalte, Daten und Workflows, bei der Skalierbarkeit und Sicherheit im Vordergrund stehen. Durch die Implementierung der Enterprise Process Center© Suite von Interfacing haben Unternehmen aus den Bereichen Biowissenschaften und Medizintechnik weltweit ihr Qualitätsmanagementsystem optimiert, ihr digitales Datenmanagement für regulatorische Zwecke verbessert und gleichzeitig benutzerspezifische Visualisierungen von Qualitätsinhalten und intelligente Modelle für nachgelagerte Auswirkungen und Bewertungen genutzt.

Verständnis von Compliance: ISO 13485, FDA QSR und GxP
Wir wissen, dass die Anforderungen an Medizinprodukteunternehmen in Bezug auf die Einhaltung von Vorschriften sehr hoch sind und dass ISO 13845, FDA QSR und GxP ein wesentlicher Bestandteil dieses Programms sind. Durch den Einsatz unserer Lösungen gewinnt Ihr Unternehmen die Verantwortlichkeit und Beständigkeit, die Ihnen einen entscheidenden Vorteil gegenüber Ihren Mitbewerbern verschafft. Unsere Tools sorgen für vollständige Transparenz von der Erstellung und Änderung einer Vorschrift über die Genehmigung und Überarbeitung der Inhalte bis hin zur Aktualisierung und Schulung der Mitarbeitenden von Standardarbeitsanweisungen (SOPs). Wir betrachten Lifecycle Management als Teil eines kompletten Ökosystems und verfolgen daher einen einzigartigen Ansatz, der gesetzliche Anforderungen, Dokumente, Prozesse, Arbeitsanweisungen und Governance miteinander verbindet.
ISO 13485
ISO 13485 ist ein international anerkannter Standard, der in folgenden Ländern eingeführt wurde: Europa, Kanada, Australien und anderen Märkten. Mit Ausnahme von Kanada ist die Anwendung der ISO 13485 nicht obligatorisch, aber sie ist die de facto Norm, die heute als Maßstab für die vollständige Einhaltung der in den Medizinproduktevorschriften festgelegten QMS verwendet wird.
US FDA QSR
Die US FDA QSR (auch bekannt als 21 CFR Part 820) wurde vor der ISO 13485 eingeführt. Alle Hersteller von Medizinprodukten in den USA müssen diese Norm für den nationalen Vertrieb erfüllen, für den internationalen Vertrieb von Produkten müssen jedoch beide Vorschriften eingehalten werden. Auch internationale Unternehmen, die mit US-Kunden Geschäfte machen wollen, müssen den QSR der US FDA erfüllen.
Ein abgestimmtes Qualitätsmanagementsystem (QMS)
Andere Länder haben eigene Kriterien, um differenzierte QMS-Anforderungen zu erfüllen. Beispielsweise haben Brasilien und Japan ihre eigenen Anforderungen, aber beide basieren auf den bestehenden Standards QSR der US FDA und ISO 13485. Positiv zu vermerken ist, dass mit diesen Normen harmonisierte Qualitätsmanagementanforderungen erreicht werden, die den US-amerikanischen, kanadischen, europäischen und allen anderen anwendbaren QMS-Normen entsprechen.
GxP-Einhaltung
Verwaltung von Inhalten
Digitale Unterschrift
Gewährleistung von Transparenz
Durchführen einer Wirkungsanalyse
Digitale SOPs
Genehmigungs- und Governance-Workflow
Förderung der Zusammenarbeit
ISO 27001 Cloud-Lösung
Im Rahmen unseres kontinuierlichen Engagements für die Einhaltung von Vorschriften und die Sicherstellung der Konformität unserer Kunden suchen wir stets nach Möglichkeiten, unsere Kunden bei der Erreichung und Aufrechterhaltung einer vollständigen Konformität zu unterstützen. Interfacing ist ISO 27001-zertifiziert und arbeitet für das Cloud-Hosting mit Amazon Web Services (AWS) zusammen, das sich nachweislich für die Einhaltung von Vorschriften einsetzt und dessen globale Rechenzentren die Anforderungen von SOC 1 Typ II und ISO 27001 erfüllen. Weitere Informationen zur Konformität von AWS mit ISO 18345, FDA QSR und GxP finden Sie im Konformitätsprogramm von AWS.






Entdecken Sie, wie Ihr Unternehmen von einer QMS-orientierten Lösung von Interfacing profitieren kann.
Ein wesentliches Unterscheidungsmerkmal von Interfacing zu anderen Beratungsunternehmen für digitale und geschäftliche Transformation ist, dass Interfacing eine eigene innovative Technologie zur Unterstützung von Transformationsprogrammen anbietet. Die QMS-basierten Lösungen von Interfacing bieten die notwendige Transparenz, um die Komplexität zu reduzieren, die Ausführung zu verbessern und Flexibilität und Wandel zu erleichtern.
Die integrierte QMS-Management-Systemlösung von Interfacing ist ein One-Stop-Shop für das Management von Transformationsprogrammen. Wir wissen, dass das Umfeld sehr wettbewerbsintensiv ist. Deshalb liegt unsere Stärke darin, während des gesamten Projektlebenszyklus flexibel zu bleiben, sei es durch unsere innovativen Produkte oder durch unser Expertenteam.
Jetzt kostenlos ausprobieren!
Dokumentieren, verbessern, standardisieren und überwachen Sie Ihre Geschäftsprozesse, Risiken und Leistung mit der Business Process Management Software (BPM Software) von Interfacing, dem Enterprise Process Center®!