Logiciel de gestion de la qualité numérique (SMQ) pour la technologie médicale
Chaque aspect du processus de technologie médicale doit être contrôlé et surveillé conformément aux exigences ISO 13845 et US FDA QSR pour les organisations de dispositifs médicaux. Afin d’assurer l’intégrité de l’entreprise et de maintenir l’assurance qualité, la mise en œuvre de normes supplémentaires telles que ISO 9000 doit être poursuivie. Cela signifie installer des processus conçus efficacement tout au long de l’opération, du développement du produit à la chaîne d’approvisionnement et à l’expédition. En adoptant une culture forte et centrée sur les processus, votre entreprise peut passer en douceur de systèmes de gestion chaotiques et ad hoc à un fonctionnement fluide qui augmentera les bénéfices.
À propos du système de gestion de la qualité des dispositifs médicaux (SMQ)
Les dispositifs médicaux (la plupart d’entre eux) nécessiteront à un moment donné une forme de SMQ, bien que la complexité du SMQ variera d’un dispositif à l’autre en fonction de sa classification. Si, par exemple, une entreprise fabrique un dispositif de classe II (risque moyen) ou de classe III (risque élevé), elle aura besoin d’un système de gestion de la qualité différent de celui de la catégorie à faible risque fabriquant des instruments chirurgicaux non réutilisables, non stériles et non mesurants. qui serait étiqueté Classe I.
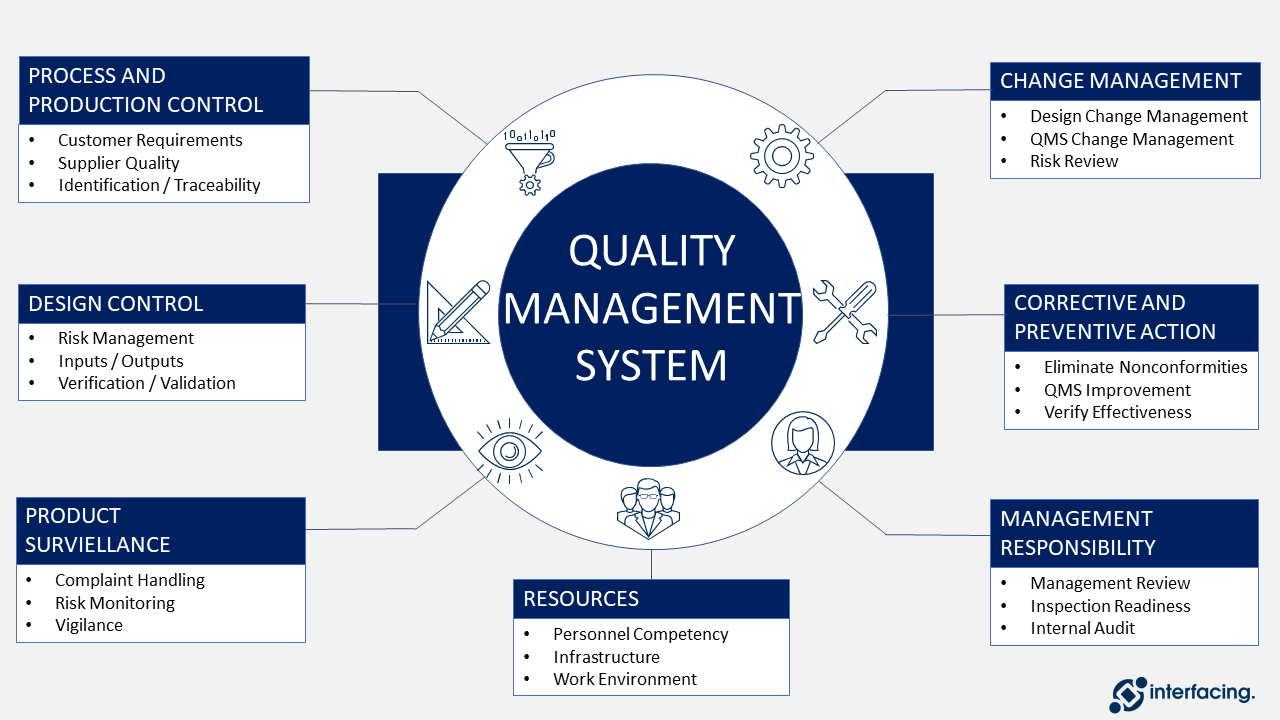
Cliquez sur l’image ci-dessous pour afficher une ventilation de la conception de base du SMQ en tant que structure générale.
Une solution conçue pour les besoins de l’industrie de la technologie médicale
De grandes entreprises des sciences de la vie se sont associées à Interfacing pour déployer des solutions de flux de travail impliquant la gestion et l’automatisation des processus d’affaire point à point. Cela comprend les processus de laboratoire, de fabrication, administratifs, liés aux produits et aux patients.
Optimisation et automatisation des processus d’Interfacing, numérisation de la documentation SOP et solution proactive de vigilance réglementaire, l’Enterprise Process Center © Suite a permis de gagner du temps grâce à une approbation et une validation accélérées, une visibilité améliorée et des améliorations opérationnelles pour les clients, notamment:
Alignement de bout en bout - Source unique de vérité
Accélération des approbations et de la validation
Signature numérique et authentification multifacteur
EPC répond aux exigences très strictes associées à la conformité aux programmes FSA QSR, ISO 13845, GxP, et tous les SOP et processus sont analysés et documentés, fournissant les pistes d’audit conformes à la norme 21 CFR Part 11 Electronic Record and Electronic Signature (ERES) et un hôte d’autres exigences réglementaires via le cryptage RSA, l’histoire des clés du coffre-fort et l’authentification multifacteur (MFA)
Vitesse et agilité améliorées
Prise en charge multilingue, traduction automatique et contenu localisé

Comprendre la conformité: ISO 13485, FDA QSR et GxP
Nous comprenons que les exigences imposées aux entreprises de dispositifs médicaux en termes de conformité sont très élevées et que ISO 13845, FDA QSR et GxP sont une partie essentielle de ce programme. En utilisant nos solutions, votre entreprise acquiert la responsabilité et la cohérence qui vous donneront une longueur d’avance sur vos concurrents. Nos outils garantissent une visibilité totale de bout en bout, de la création et de la modification d’un règlement à l’approbation et à la révision du contenu en passant par la mise à jour et le recyclage des employés aux procédures opérationnelles normalisées (SOP). Nous considérons la gestion complète du cycle de vie comme des éléments mobiles d’un écosystème complet et c’est pourquoi cette approche unique combine les exigences réglementaires, les documents, les processus, les instructions de travail et la gouvernance.
ISO 13485
QSR de la FDA des États-Unis
SMQ nuancé
Conformité GxP
Gérer le contenu
Signature numérique
Assurer la transparence
Effectuer une analyse d'impact
SOP numériques
Flux de travail d'approbation et de gouvernance
Encouragez la collaboration
Solution cloud ISO 27001






Découvrez comment votre organisation bénéficie d’une solution d’interfaçage axée sur le SMQ.
L’un des principaux facteurs de différenciation d’Interfacing par rapport aux autres sociétés de conseil en transformation numérique et d’affaire est qu’Interfacing propose sa propre solution technologique innovante pour soutenir les programmes de transformation. Les solutions QMS d’Interfacing offrent la transparence requise pour réduire la complexité, améliorer l’exécution et faciliter l’agilité et le changement.
QMS d’interfaçage système de gestion intégré solution est un guichet unique pour la gestion des programmes de transformation. Nous savons que c’est un environnement très concurrentiel. C’est pour cette raison que notre force réside dans notre engagement à maintenir la flexibilité tout au long du cycle de vie du projet que ce soit dans nos produits innovants ou dans notre équipe d’experts.
Essayez-le maintenant gratuitement!
Documentez, améliorez, standardisez et surveillez vos processus d’affaires, risques et performances avec le logiciel de gestion des processus d’affaires (BPM) d’Interfacing, l’Enterprise Process Center® !