eQMS : automatisation de la qualité
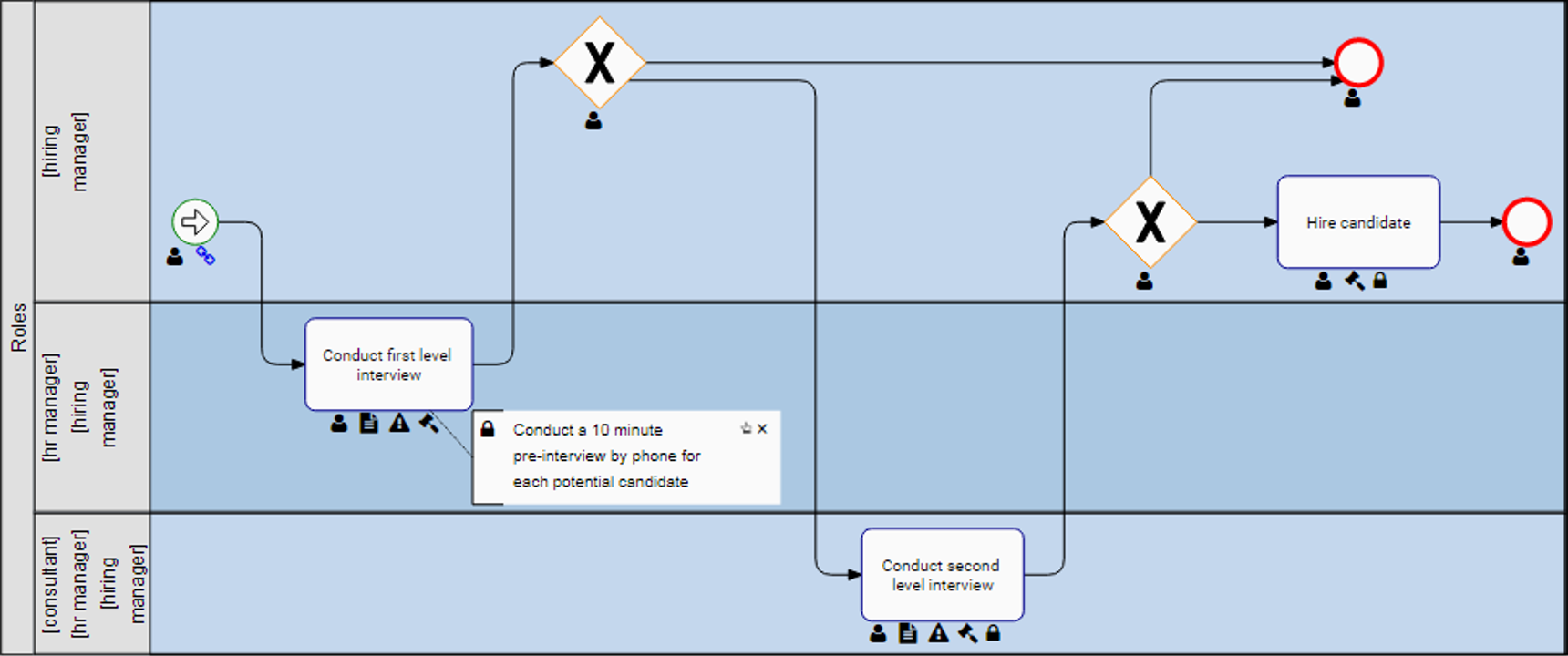
Qu’est-ce qu’un système de gestion de la qualité (QMS)
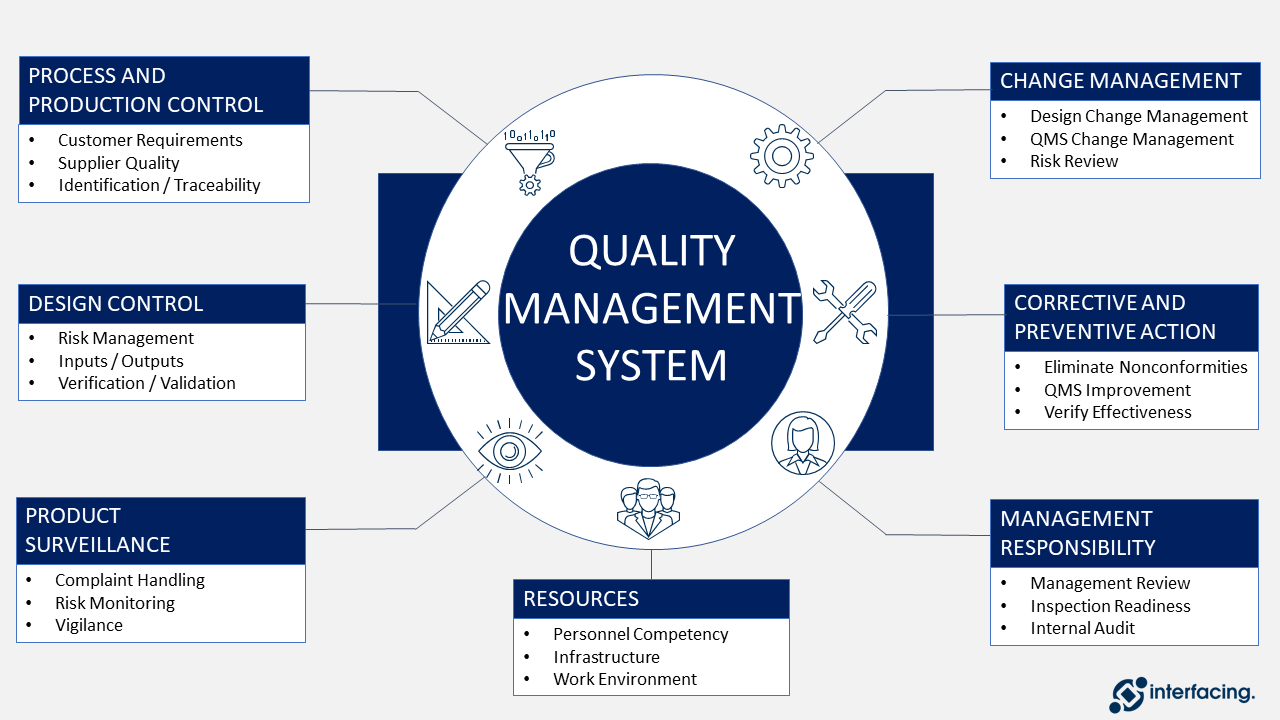
Selon l’ASQ (American Society of Quality) : le système de gestion de la qualité (SGQ) est défini comme un système formalisé qui documente les processus, les procédures et les responsabilités pour atteindre les politiques et les objectifs de qualité. Un système de gestion de la qualité permet de coordonner et de diriger les activités d’une organisation afin de répondre aux exigences des clients et de la réglementation et d’améliorer son efficacité et son efficience de manière continue.
Voir l’image ci-dessous pour voir une répartition de base de la conception du QMS en tant que structure générale.
Système électronique de gestion de la qualité (EQMS)
Les organisations d’aujourd’hui sont tenues de s’assurer que la qualité, la conformité et de nombreuses autres réglementations spécifiques à l’industrie sont respectées en ce qui concerne leurs processus de production et de prestation de services. Afin de s’assurer que ces réglementations respectent les normes de l’industrie, les entreprises adopteront une solution de système de gestion de la qualité eQMS.
Ces solutions eQMS ont progressivement évolué au fil du temps, ayant commencé comme des feuilles de calcul de base à l’origine. Les entreprises tireraient parti de ces feuilles de calcul dans le suivi et la gestion de leurs processus qualité. Avec l’évolution des ressources informatiques, les systèmes eQMS sont apparus comme des solutions logicielles fiables exécutant des processus, identifiant les responsabilités et détaillant les procédures pour la réalisation des objectifs et la conformité aux politiques. Considérez-le comme une plate-forme QMS intégrée à une infrastructure informatique et à un modèle de données facilitant la collaboration et la communication interfonctionnelles.
Bien qu’il existe des fonctionnalités personnalisées variables intégrées en fonction de l’industrie, des plates-formes de livraison, de la taille de l’organisation, etc., il existe quelques fonctionnalités typiques dans lesquelles on investit généralement. Ceux-ci incluraient :
- Plateforme Web
- Adopter une approche BPM de la fonctionnalité implique des applications qui sont construites sur une plate-forme avec une intégration à d’autres applications.
- Interopérabilité avec d’autres applications de planification des ressources d’entreprise (ERP).
- L’interface graphique est basée sur les rôles et se concentre sur l’exécution de processus de flux de travail.
Capacités eQMS d’Interfacing
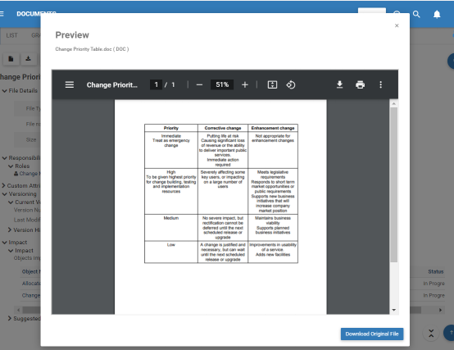
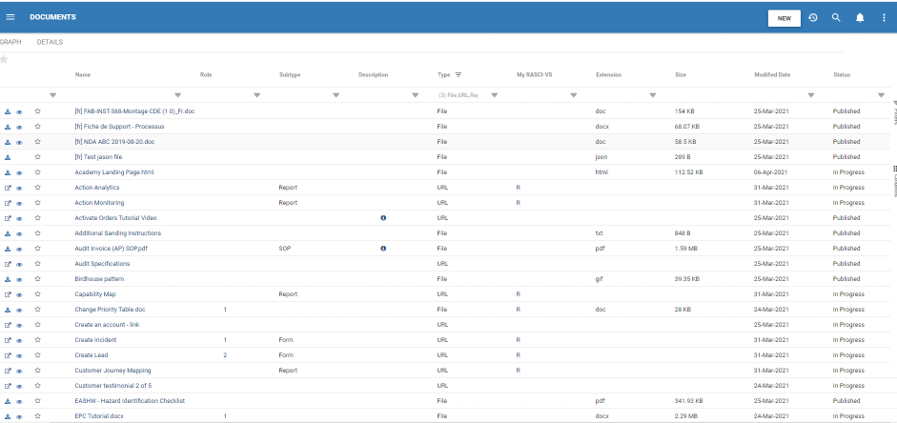
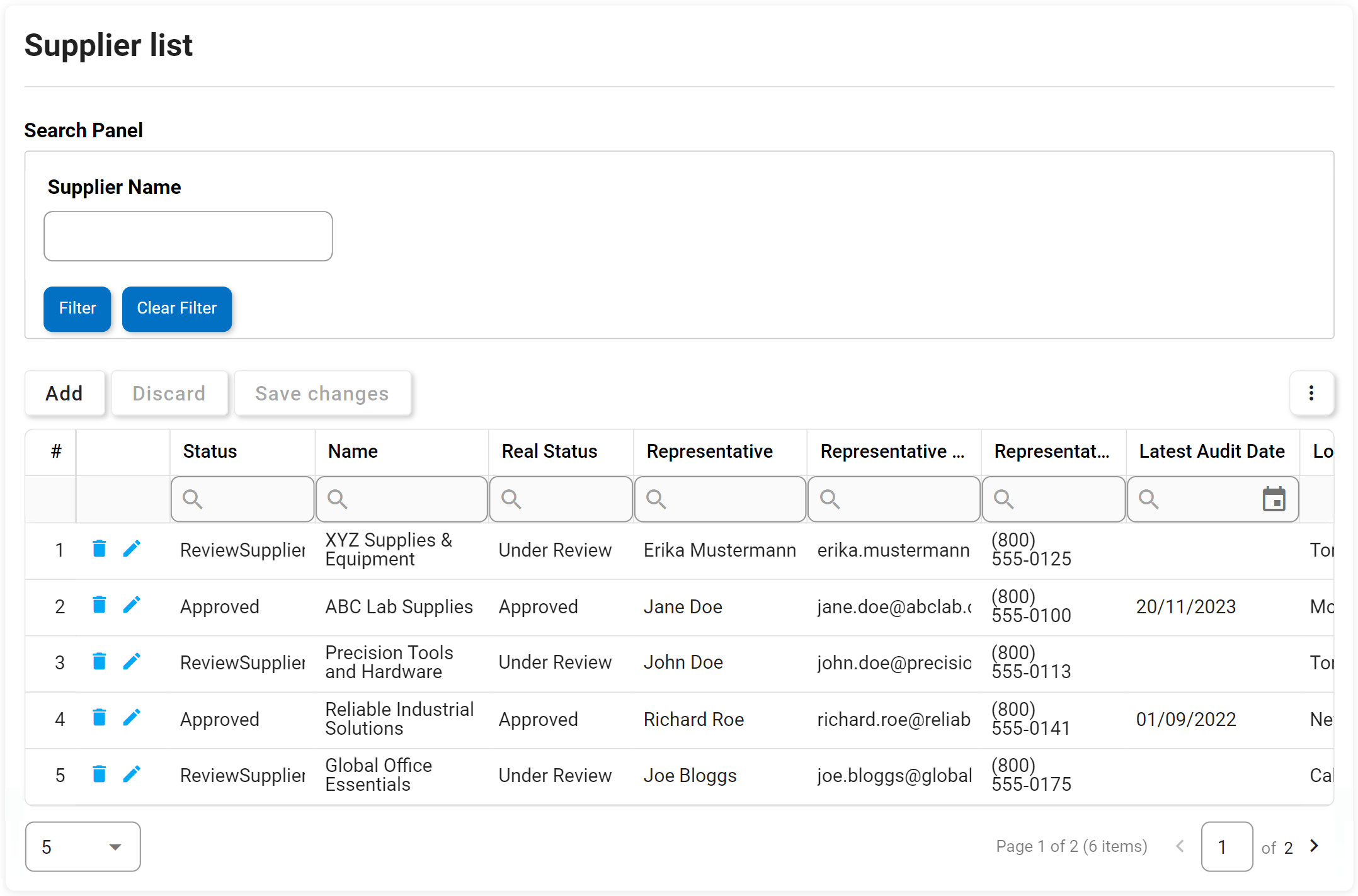
Gestion des documents et des archives
Il n’est rien de moins qu’un défi, voire presque impossible, de maintenir aujourd’hui un système de documents papier conforme à la norme ISO. L’ensemble de fonctionnalités du système serait lourd, sujet aux erreurs et chronophage. Votre productivité augmenterait considérablement en automatisant toutes les tâches répétitives associées à la gestion des documents QMS. L’eQMS d’EPC ajoute une visibilité claire sur le cycle de vie des documents et surveillera de manière proactive l’état du flux de travail de votre organisation tout en améliorant également l’efficacité du système qualité.
Les équipes dispersées géographiquement sont désormais en mesure de se connecter, de collaborer, de co-créer, de relire, de réviser, de commenter et de signer des documents, le tout de manière électronique et sécurisée au sein du système. Les notifications automatiques par e-mail et les confirmations de lecture prennent en charge les systèmes pour accélérer le processus de distribution dans toute l’organisation. La conservation automatique des documents, l’impression, les révisions périodiques et l’archivage sont tous entièrement conformes et contrôlés à l’aide du cryptage USFDA 21 CFR partie 11, ce qui rend les audits et les inspections de qualité sans souci.
Principales caractéristiques:
- Ajout de nouveaux documents
- ID uniques et balises par document
- Contrôle de version par document
- Archiver, déplacer et supprimer des documents existants
- Struture de documents dans une hiérarchie, des dossiers
- Crée des modèles pour les archives et la possibilité de réutiliser le modèle de flux de travail
- Registre des audits / suivi des modifications apportées aux métadonnées
- Flux de travail pour les approbations, révisions
- Signature électronique sur les approbations
- Délégation des révisions, approbations
- Notifications, e-mails pour les flux de travail
- Vérification du système pour les publications et les approbations
- Collaborer et soulever des demandes de changement
- Prise en charge multilingue – UI, suggestions de traduction de métadonnées et documents
Recherche de documents puissante par :
- Nom du document
- Identifiant du document
- Unité organisationnelle
- Texte intégral
- Métadonnées (Type, Catégories, Attributs)
- Colonnes filtrables
- Dernières données modifiées
- Dernière modification par
- Tous les attributs définis par l’utilisateur (UDA)
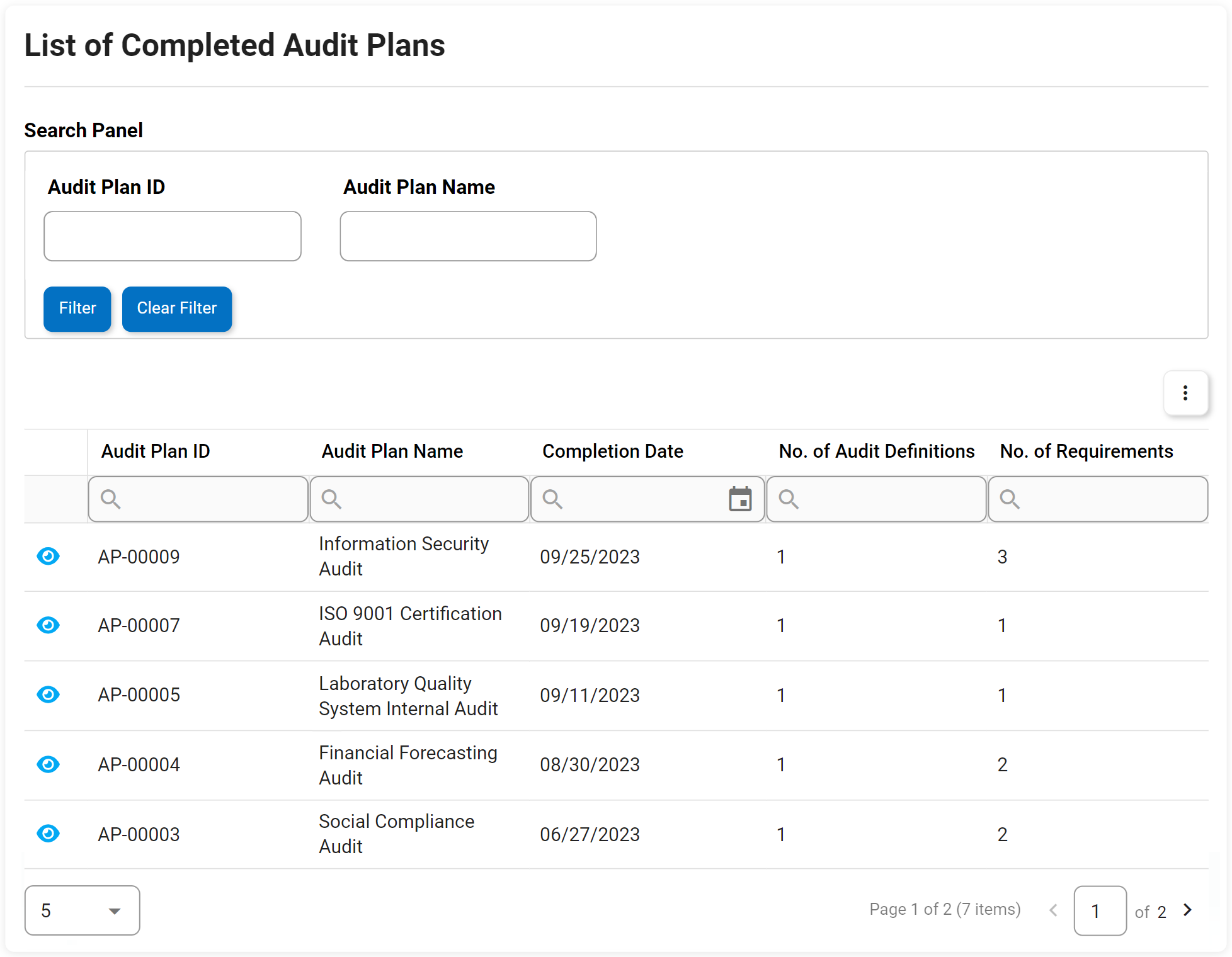
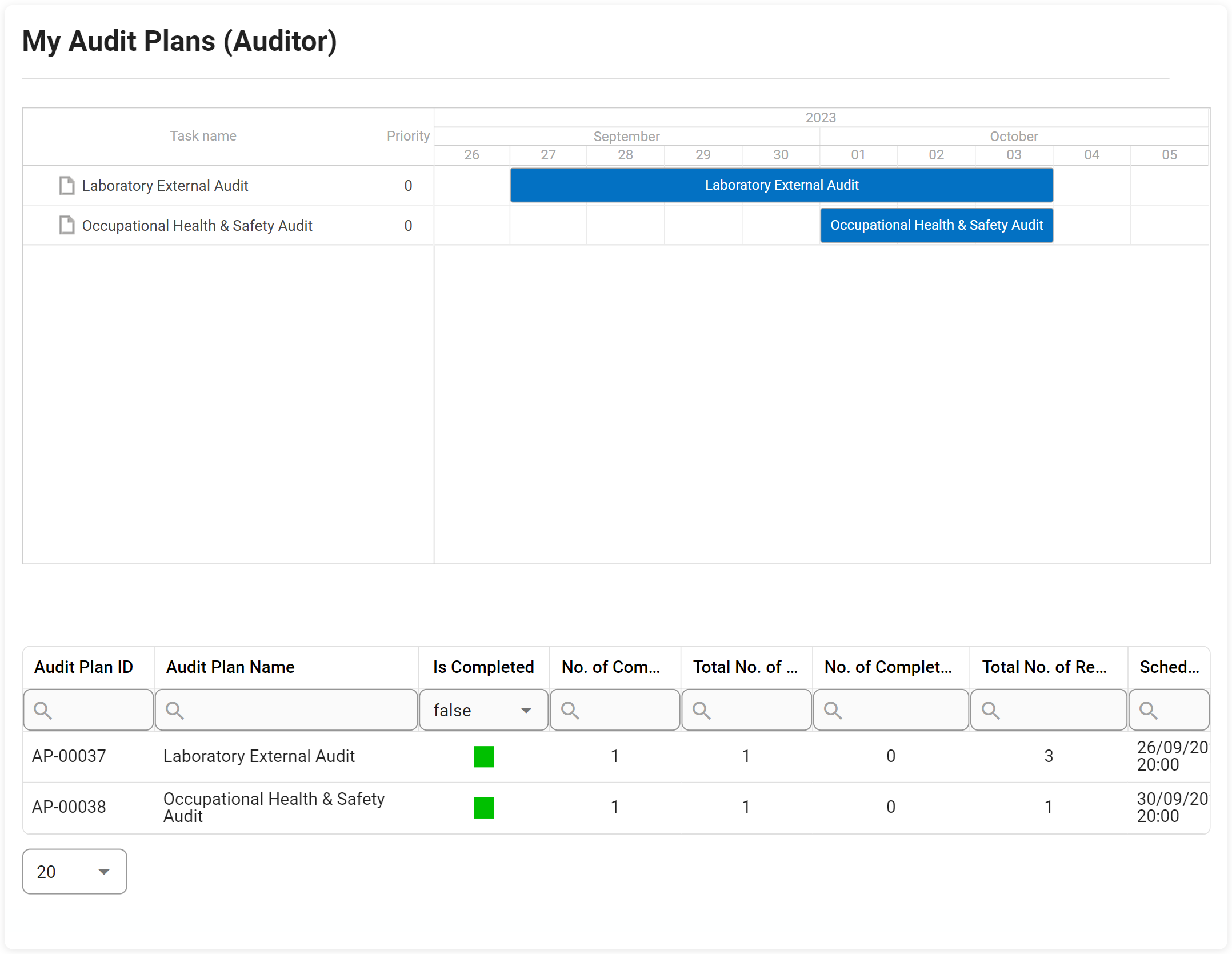
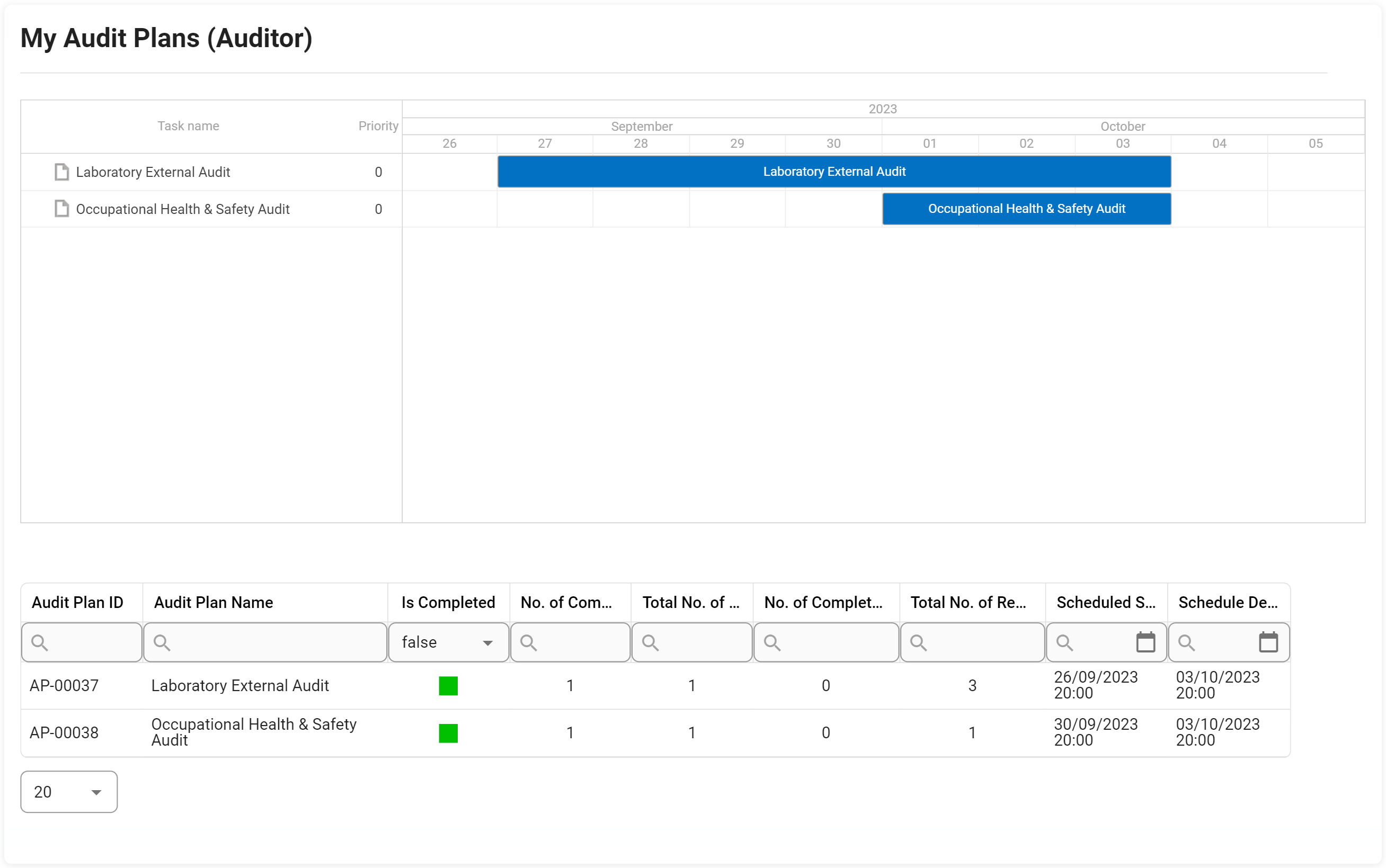
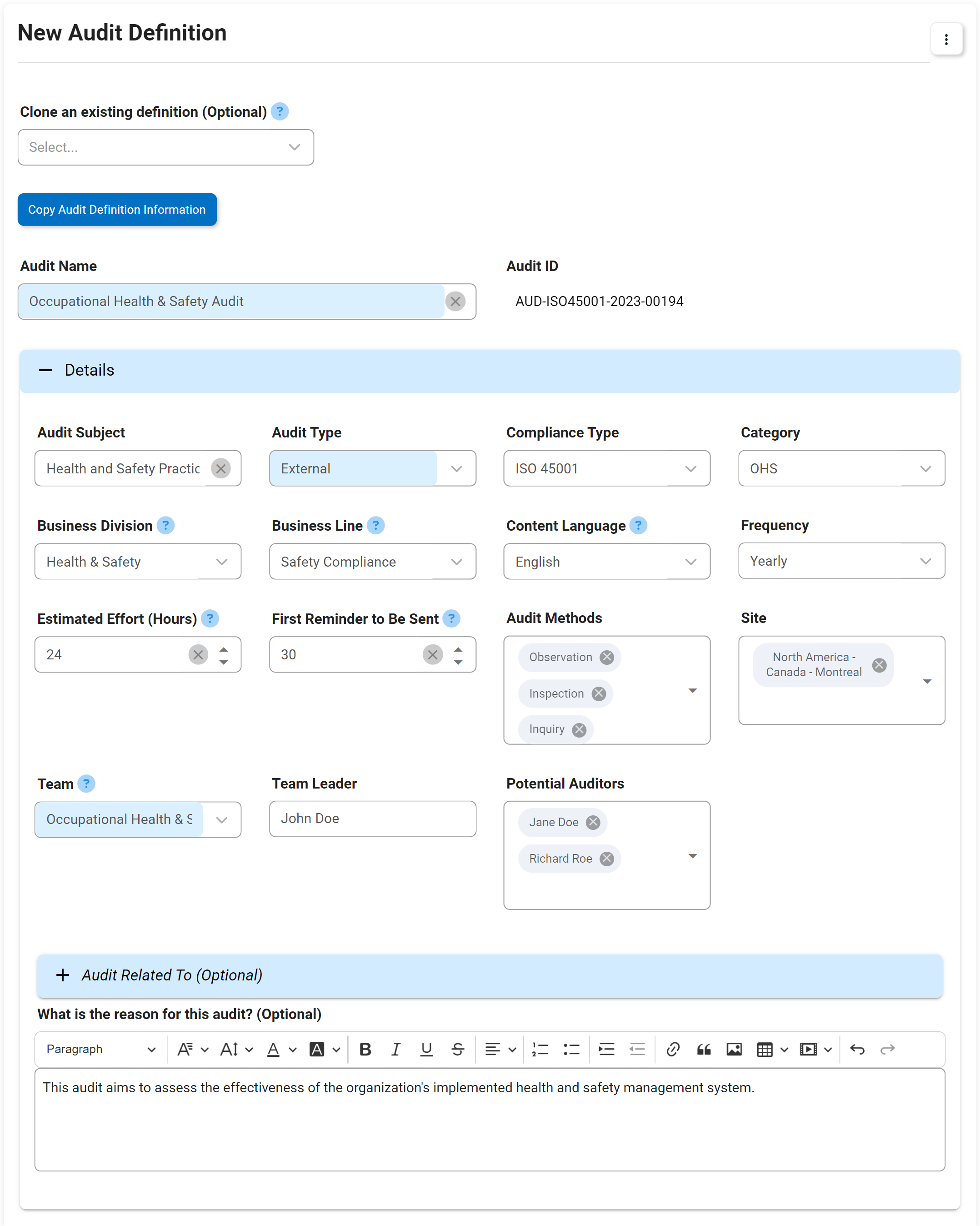
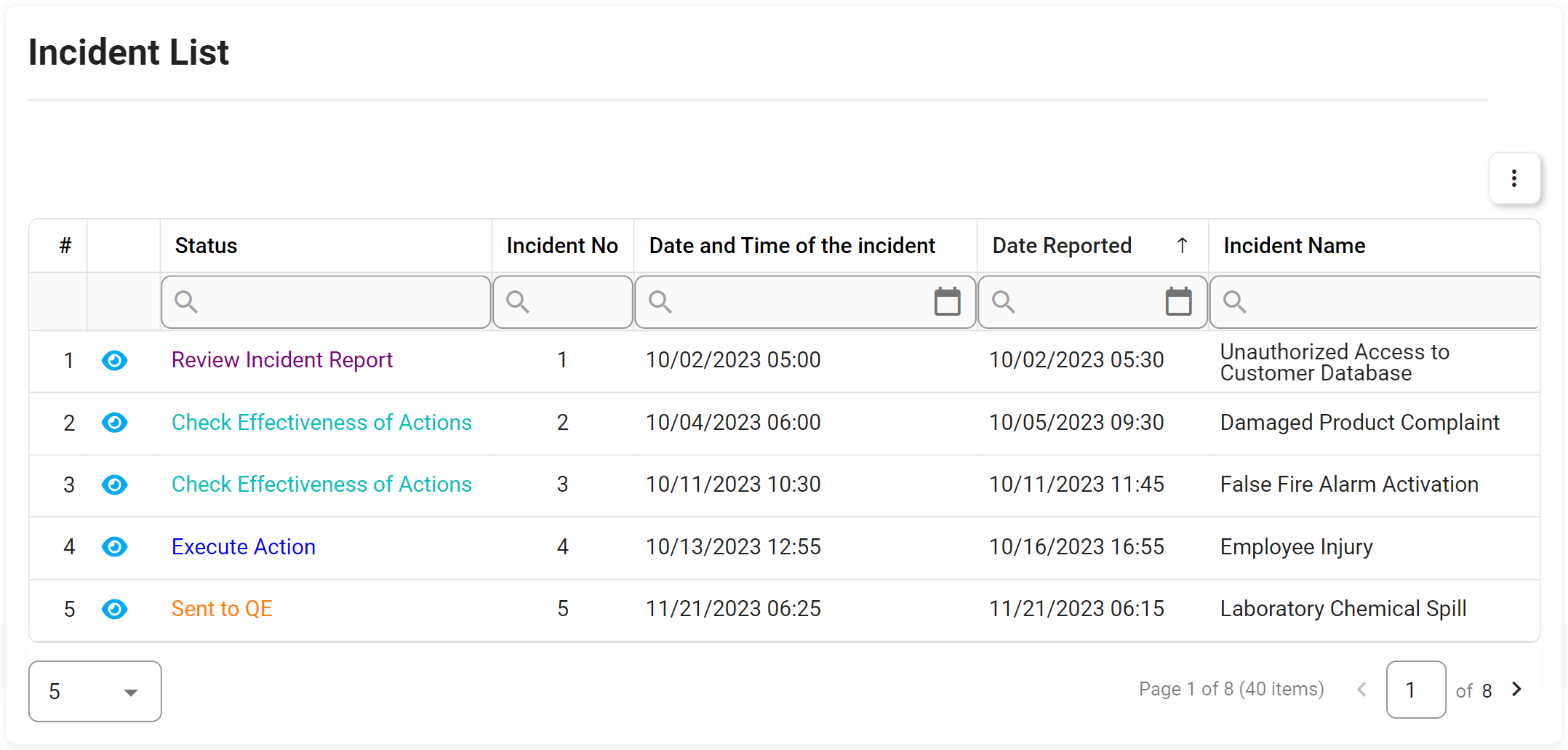
Gestion des audits
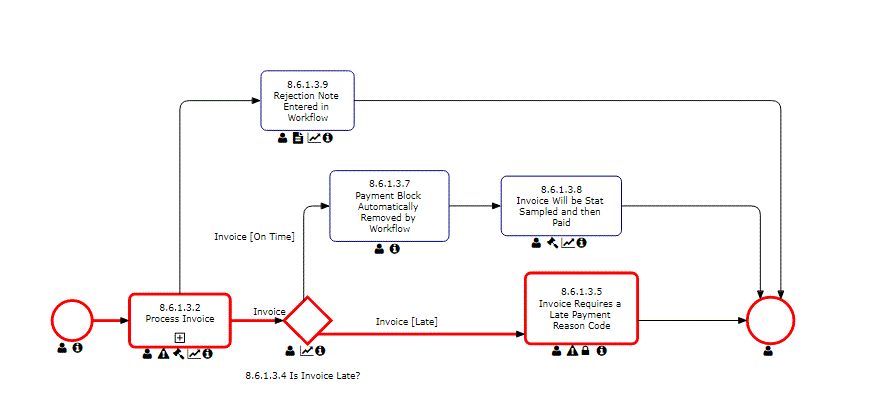
Le support de gestion d’audit d’Interfacing pour votre organisation inclut la conformité aux normes d’une grande variété d’audits internes et externes. Les normes de la FDA, de l’ISO, des audits de qualité et cliniques sont quelques-unes des agences gouvernementales établissant les spécifications de conformité qui doivent être respectées. Notre DBP automatisera les tâches normalement effectuées manuellement dans Excel, offrant la possibilité de réutiliser les définitions d’audit et d’autres exigences en matière de tests, de preuves et d’échantillonnage ; ce qui signifie que vous n’aurez besoin de définir les exigences d’audit et de test qu’une seule fois, et de les utiliser dans plusieurs audits. Cela inclut la capacité à réaliser des audits internes et externes (fournisseur, client, exigences réglementaires, etc.).
En utilisant notre Digital Business Platform, vous pourrez non seulement suivre l’audit étape par étape, mais aussi escalader l’audit avec des constatations majeures ou mineures jusqu’au CAPA dans le cadre de la gestion des éléments d’action. L’un de nos outils est utilisé dans les diagrammes de Gantt concernant la planification des audits, la gestion des capacités, la gestion des exigences ISO, etc.
Principales caractéristiques:
- Capturez toutes les instances d’audit et de test dans un seul référentiel
- Recherchez et triez les champs d’audit par ID, nom, fréquence, taille d’échantillon, etc.
- Audit ad hoc déclenché pour démarrer et audit préprogrammé
- Définissez les attributs d’audit clés tels que l’auditeur et l’audité, la date limite, le déclencheur de démarrage, les conditions préalables, etc.
- Afficher, modifier et ajouter des exemples de résultats à différentes fins d’audit
- Déterminer l’efficacité et la précision de l’échantillon grâce aux boutons d’automatisation
- Réaliser des essais et des rapports d’audit
Déclencheurs, escalade et validation
- Déclencher CAPA via des audits échoués, des incidents ou des demandes ad hoc
- Ajoutez plusieurs éléments d’action (IA) qui définissent des critères spécifiques (par exemple, le nom de l’IA, le propriétaire, le type d’action, la priorité, etc.)
- Attribuez des IA à des ressources spécifiques avec des délais et un niveau de priorité clairs
- Demande de CAPA d’escalade automatique à son propriétaire d’IA ou à un autre rôle de responsabilité égale en cas d’absence de son propriétaire d’IA
- Autoriser le propriétaire de l’IA à demander une extension sur son IA assignée
- Recueillir et stocker des preuves d’IA pour valider l’achèvement
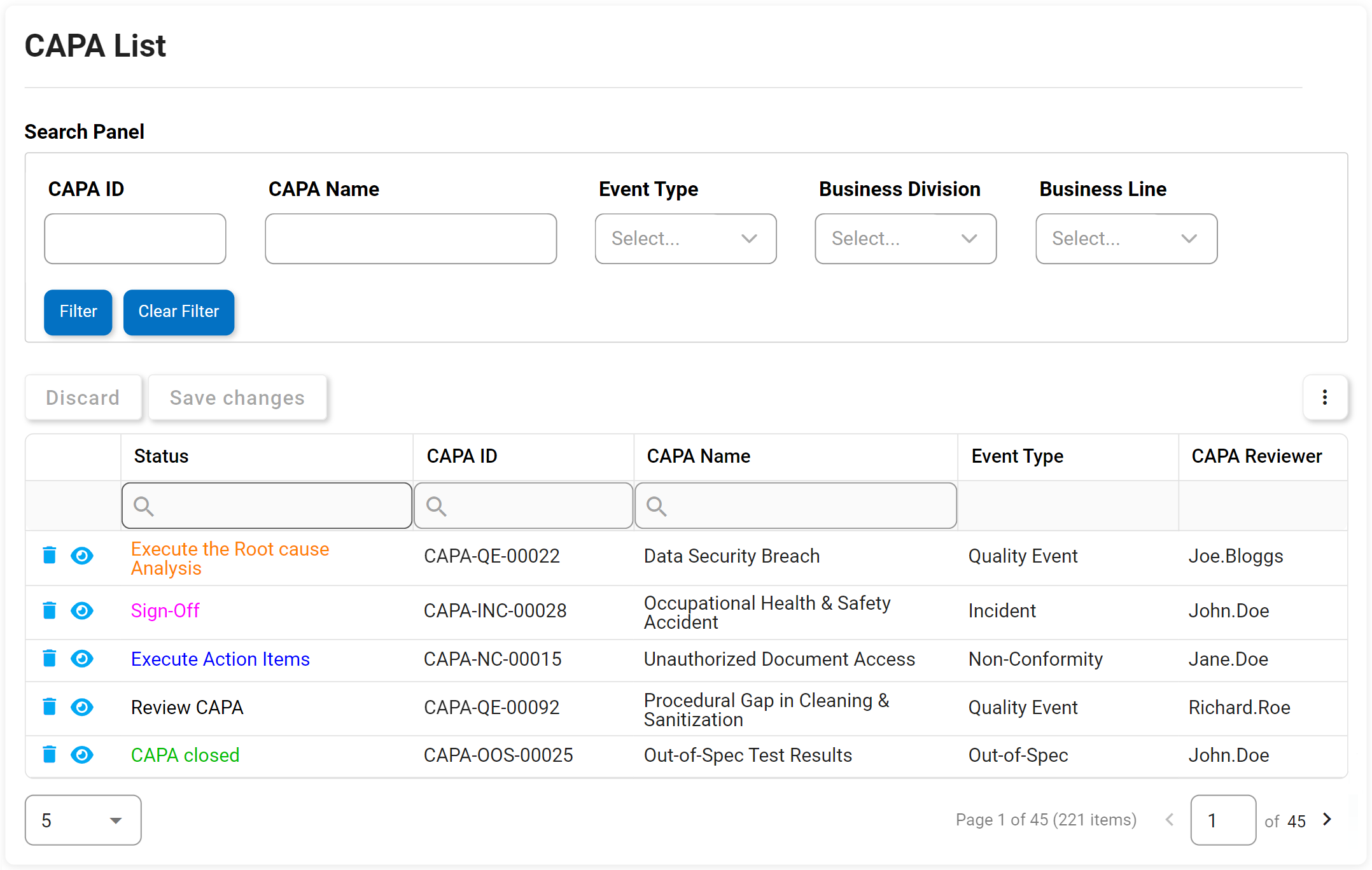
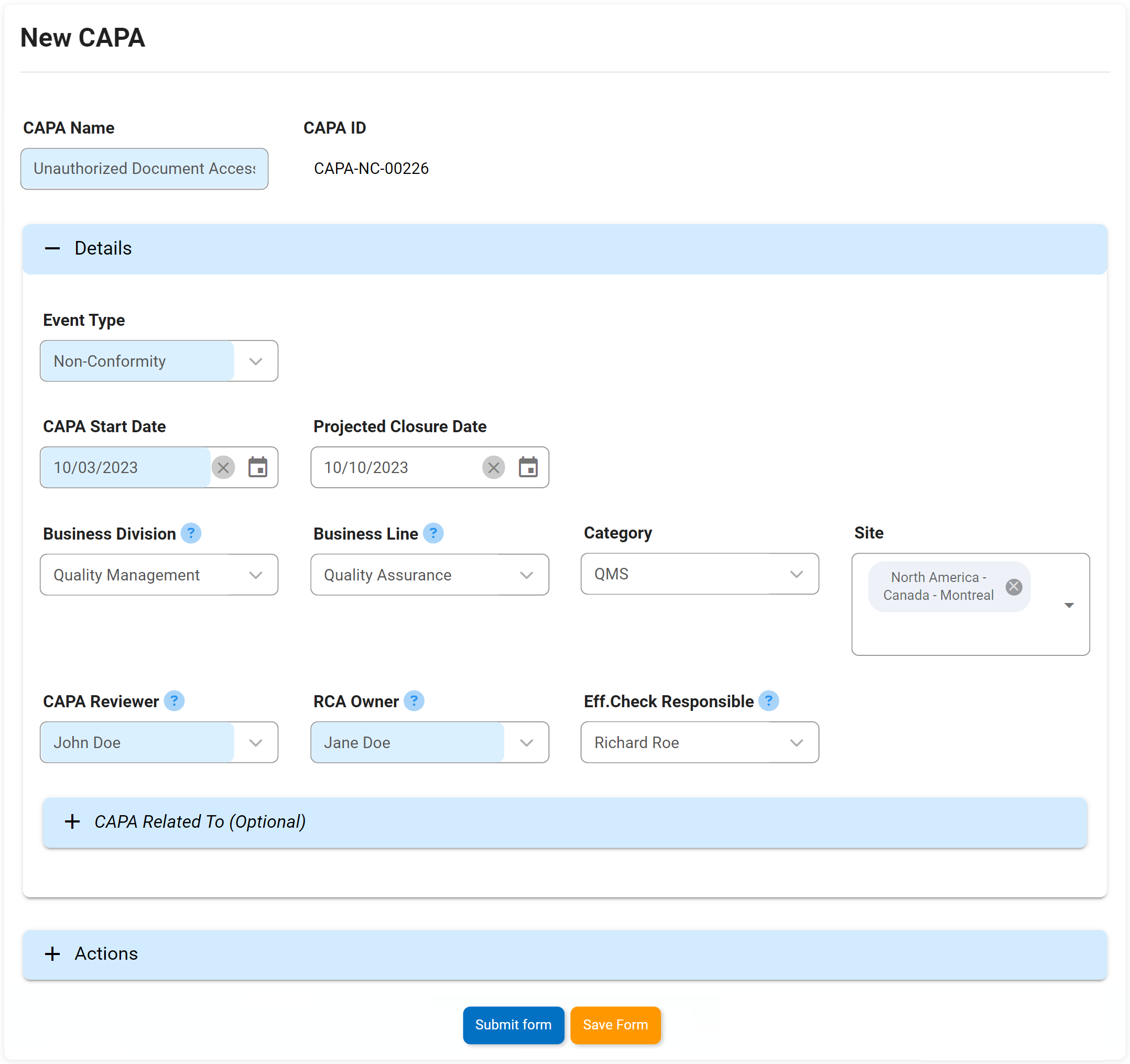
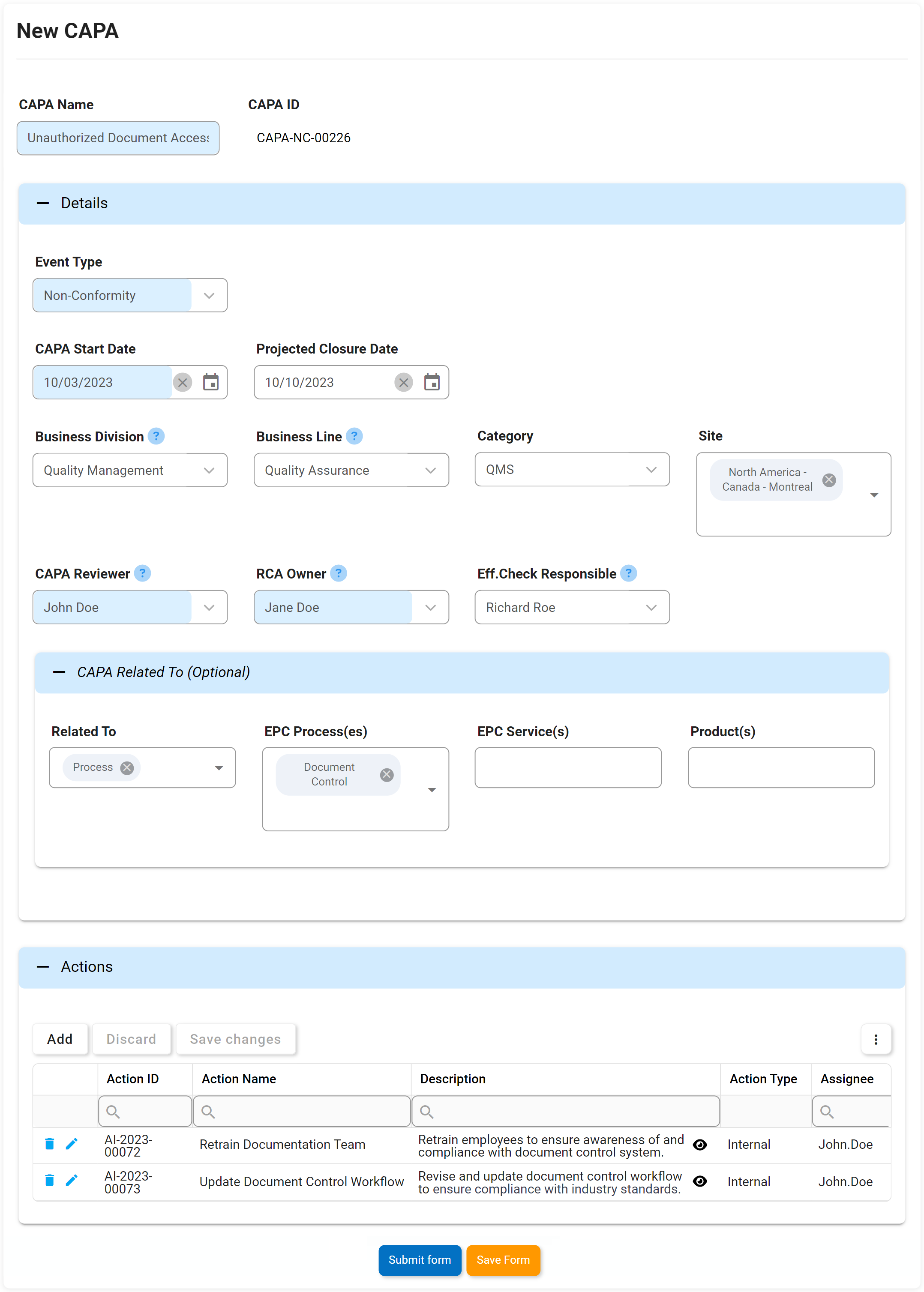
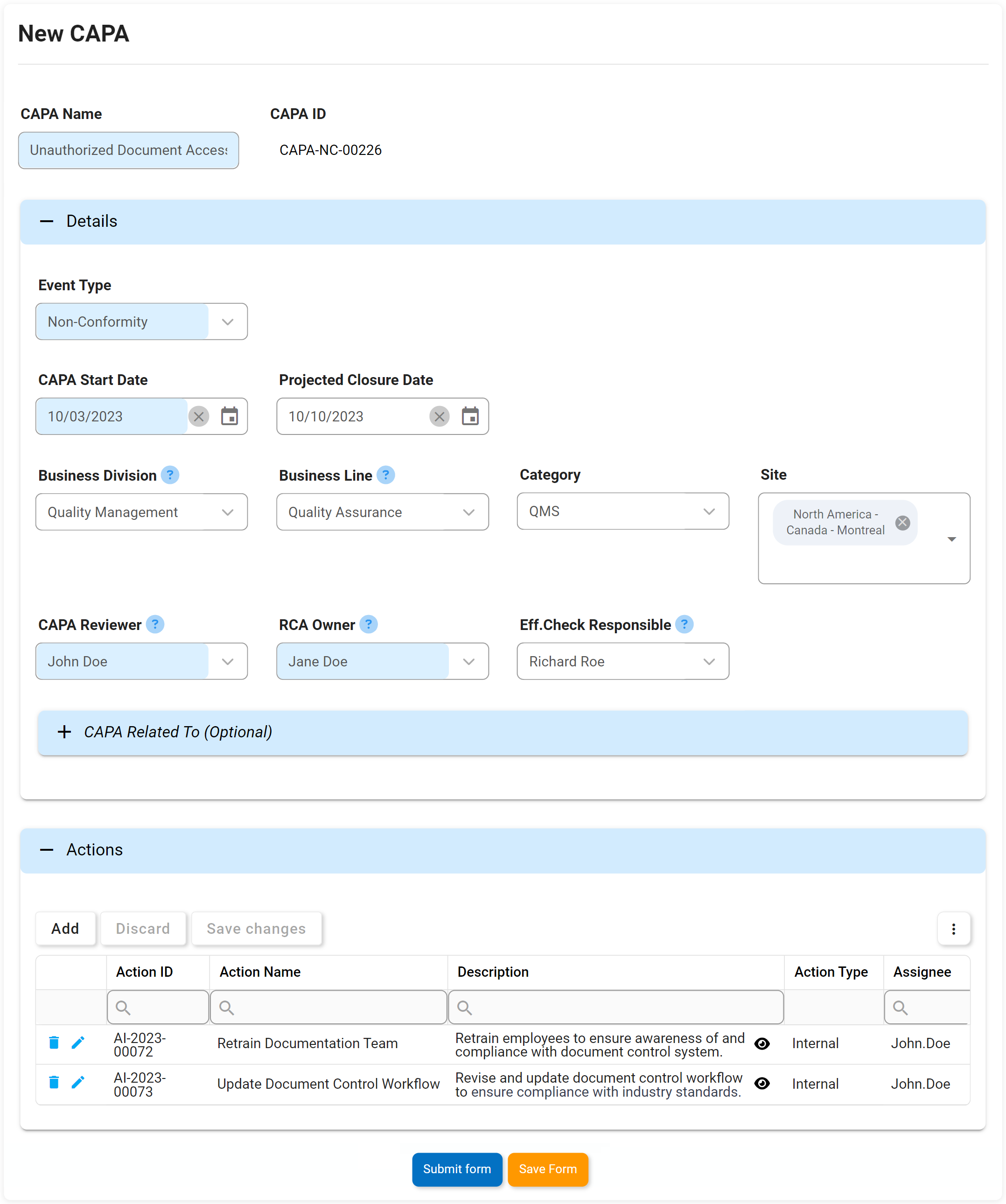
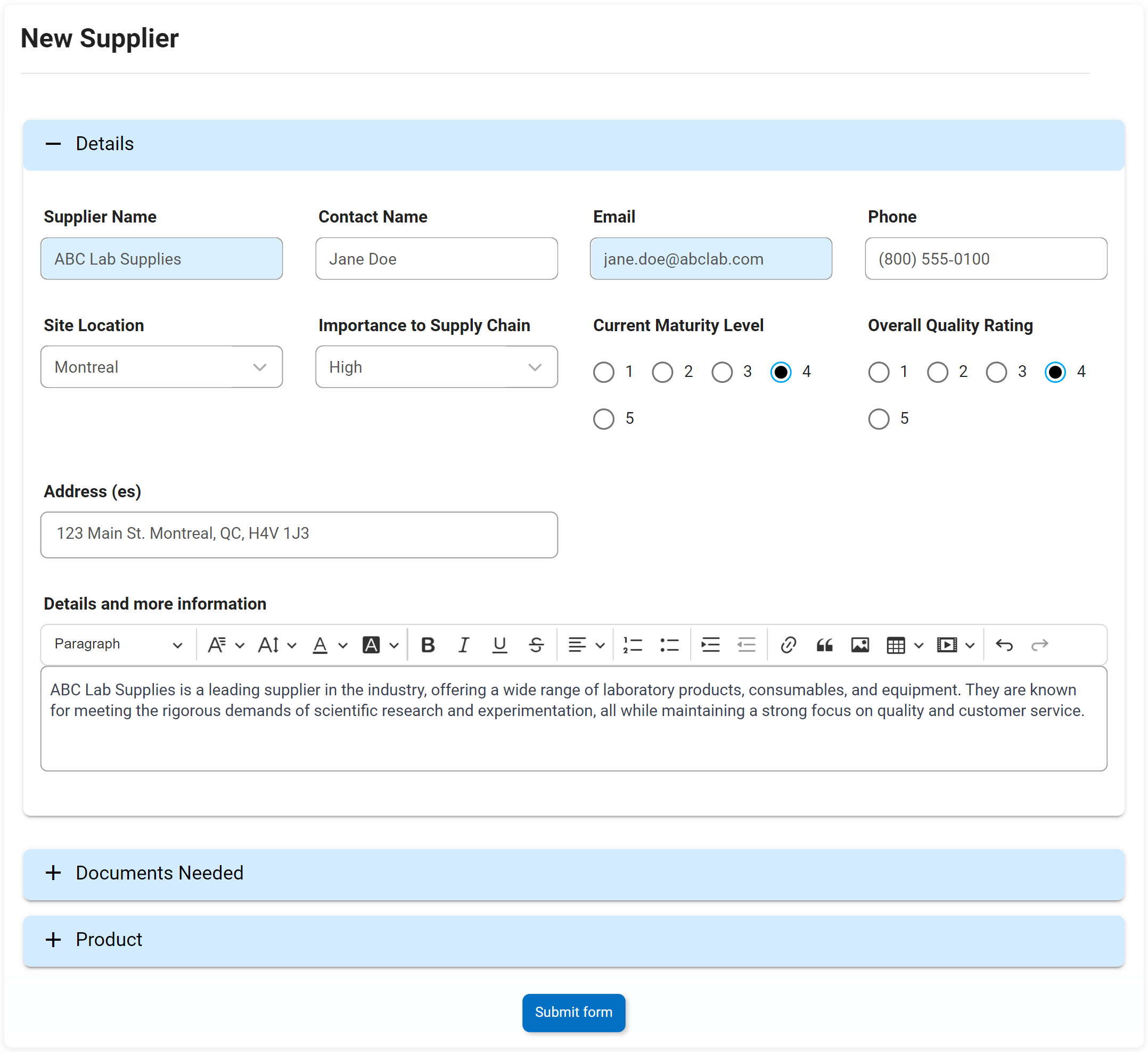
Actions correctives et préventives (CAPA)
Nous pensons à CAPA un peu comme le système immunitaire d’une organisation. Si un écart ou une panne systémique se produit dans les processus ou les étapes de fabrication d’une organisation, CAPA est le processus rigoureux en place qui identifiera pourquoi le défaut ou la défaillance s’est produit. Action corrective L’action préventive (CAPA) est le processus utilisé pour enquêter et résoudre les problèmes des organisations, et identifiera et prendra des mesures correctives pour empêcher la réapparition des causes profondes. Le DBP d’Interfacing aide CAPA à prévenir la récurrence de toute cause fondamentale d’une panne ou d’un défaut.
Notre DBP augmentera soit sur une base ad hoc, soit à la suite d’un incident ou des résultats d’une enquête d’audit. Il soulèvera des actions qui peuvent être retracées à une source et mises en œuvre dans le cadre d’un plan de gestion des éléments d’action.
Attributs clés:
- Date de levée
- Type
- Date limite
- Description du problème
- Cause première
- Éléments d’action CAPA
- Onglet Test Info – affiche tous les tests terminés hérités du formulaire précédent
- Échec de l’audit ou informations sur l’incident héritées sur le formulaire
- Afficher/modifier/ajouter plusieurs éléments d’action CAPA
- Rôles responsables et état des éléments d’action disponibles en temps réel
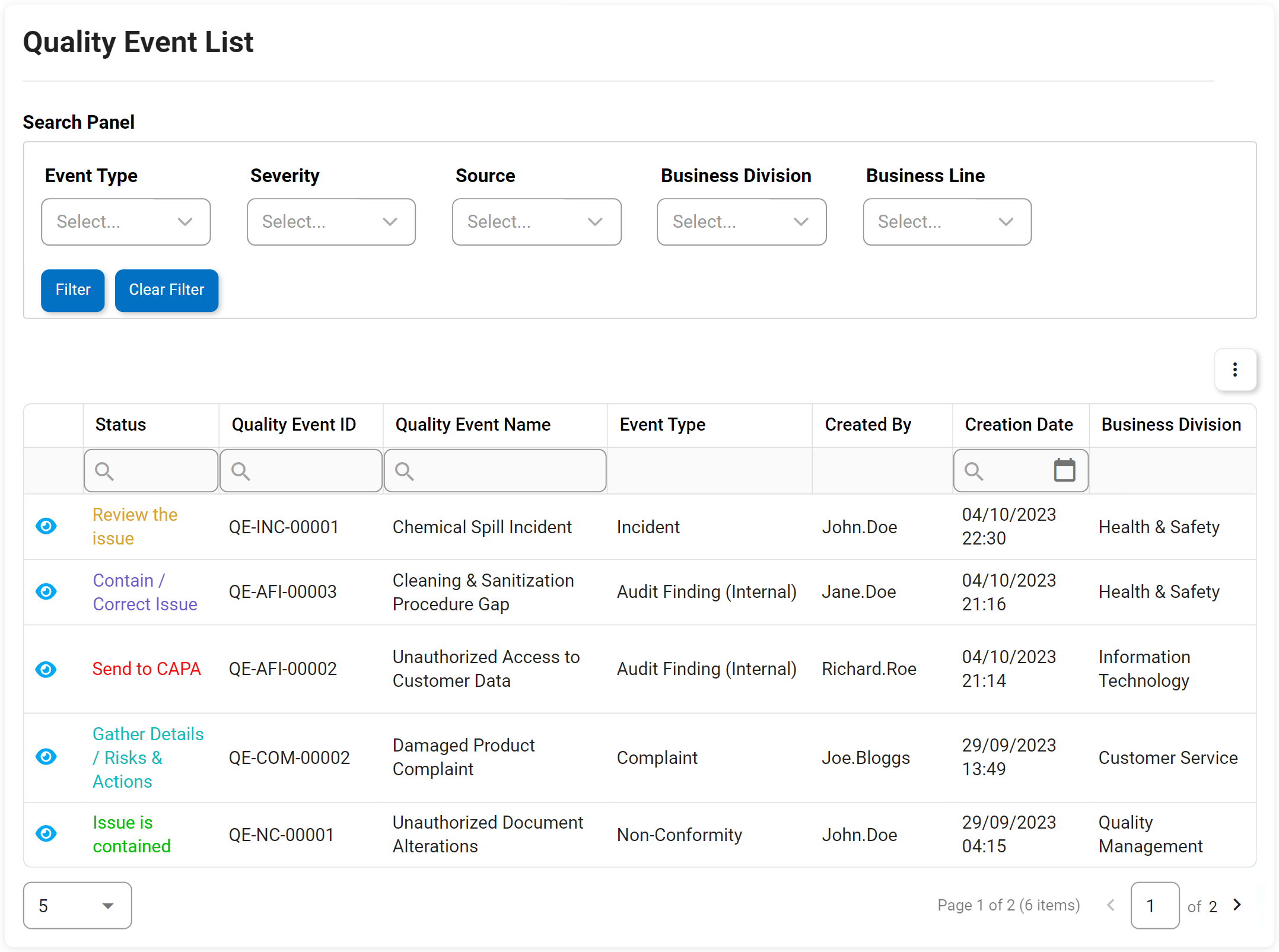
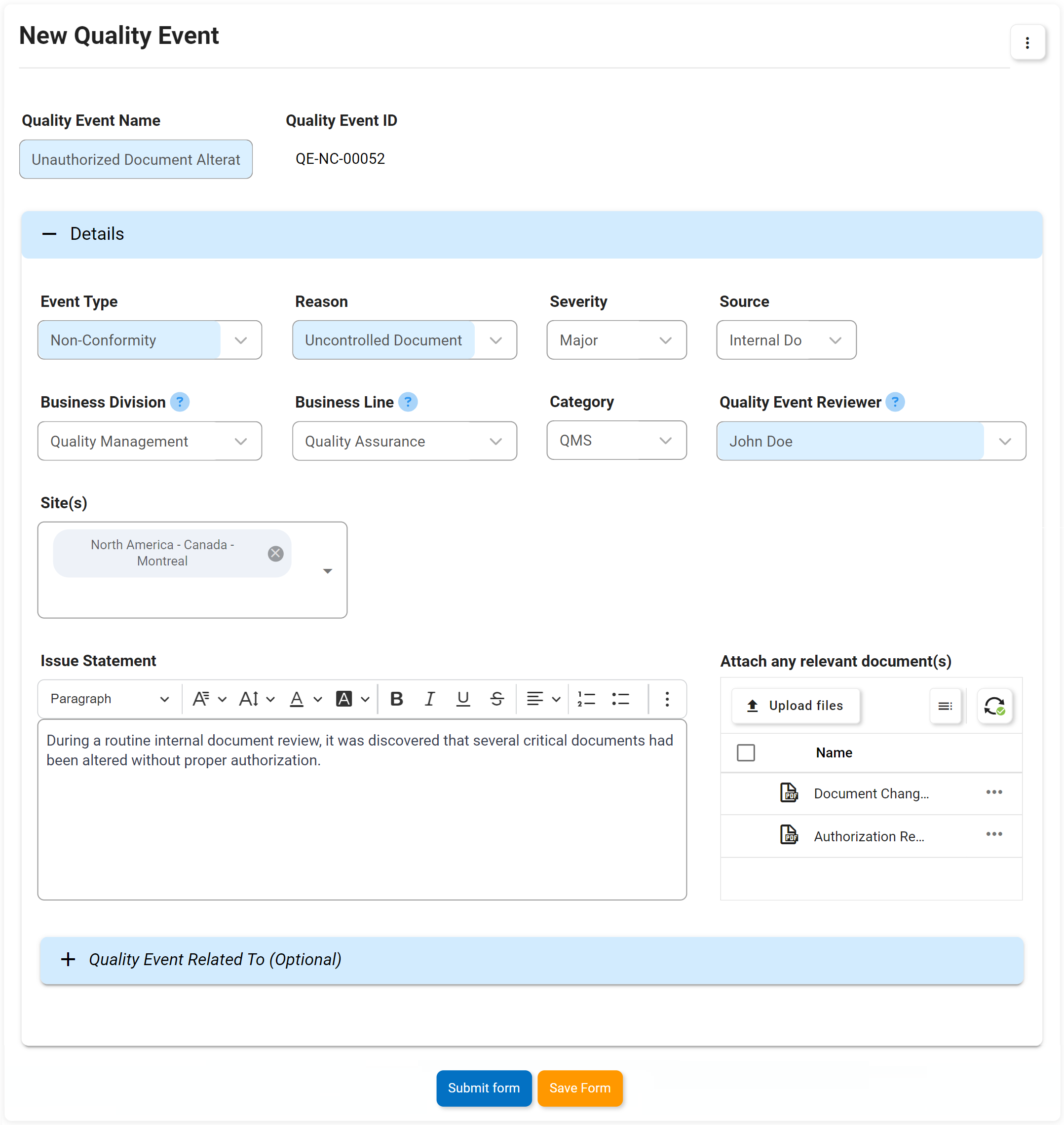
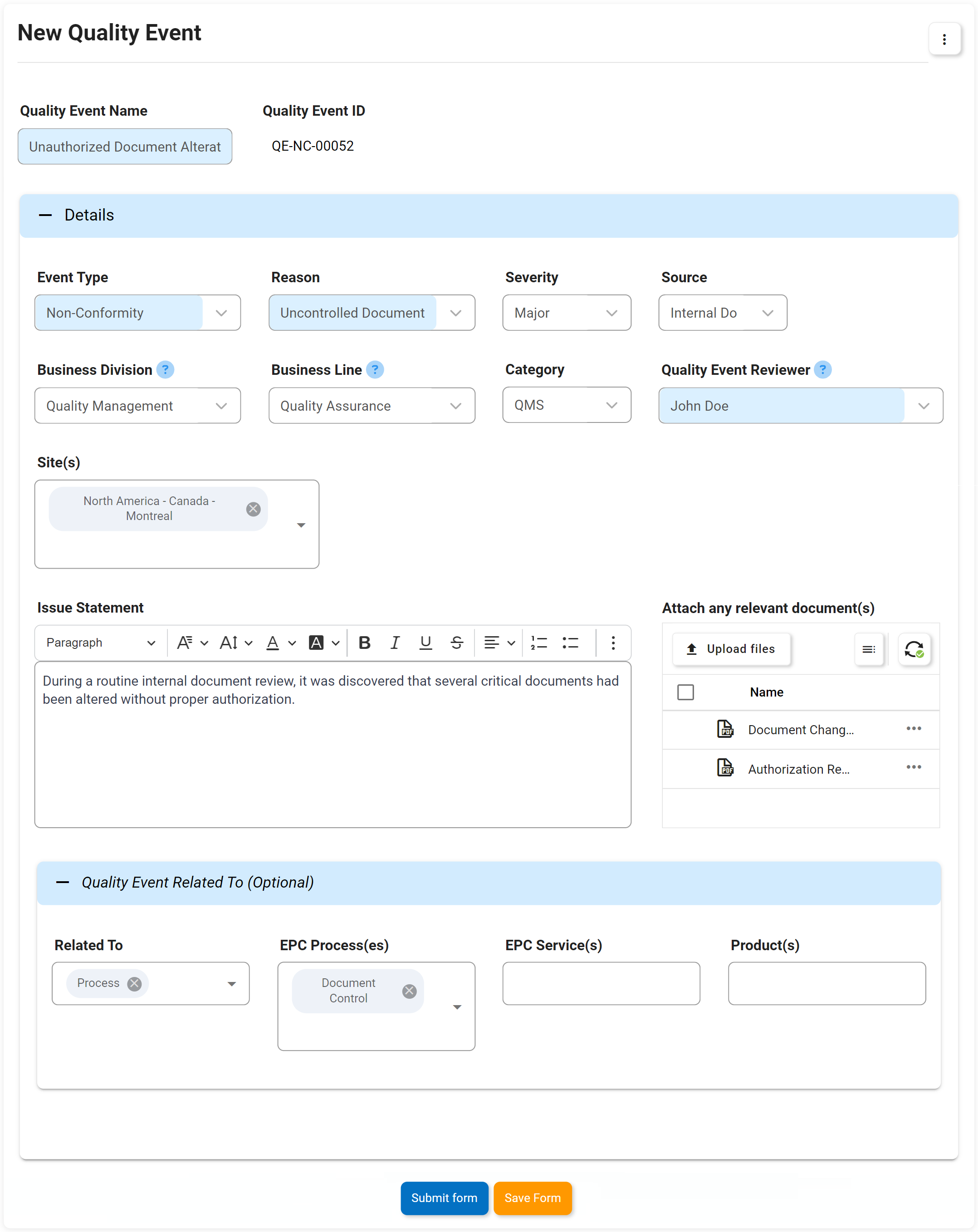
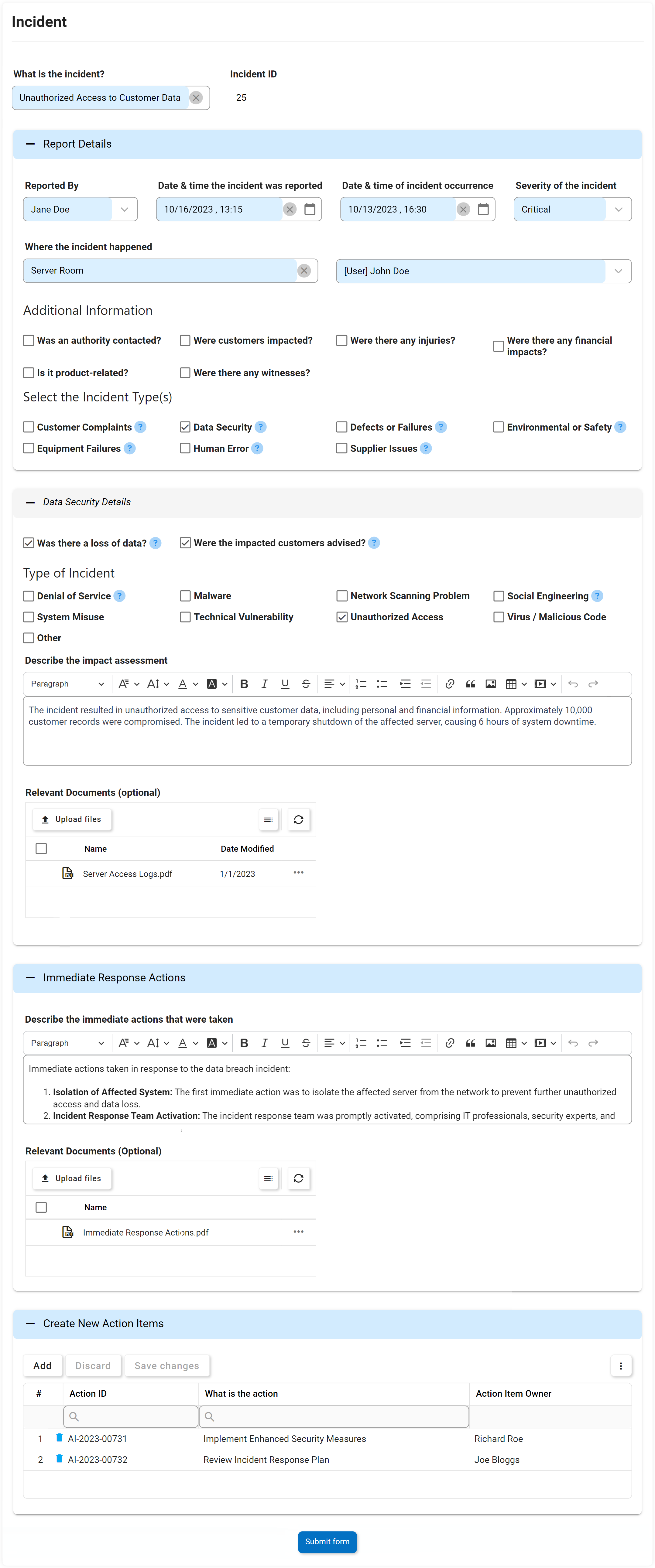
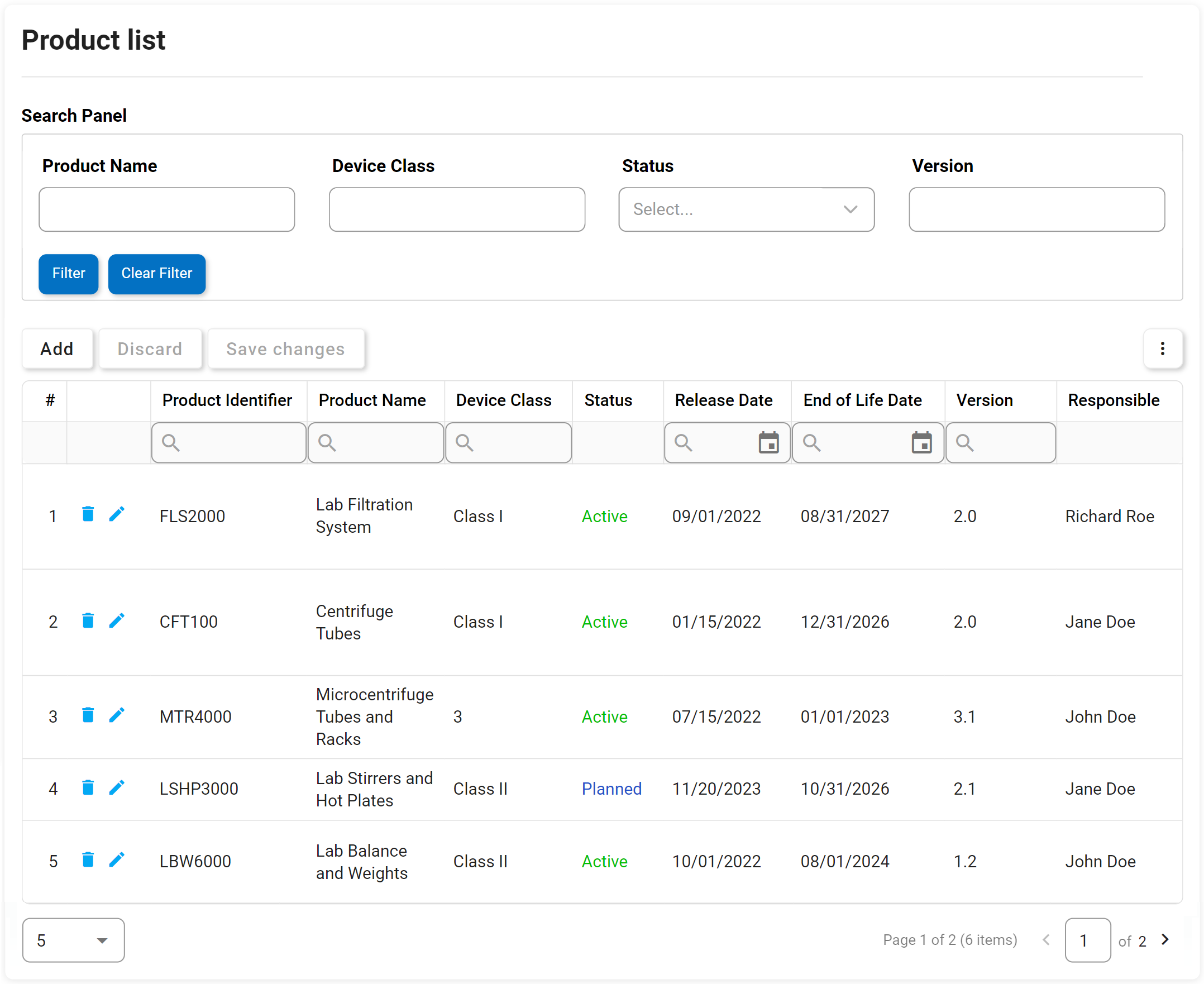
Événements de qualité, y compris non-conformité, réclamation, etc.
La gestion des non-conformités est une exigence pour répondre aux normes ISO 9001. La solution logicielle eQMS Digital Business Platform (DBP) d’Interfacing combine la gestion des documents et des processus pour améliorer significativement la gestion des éventuelles non-conformités et leurs plans d’action associés. Avec notre DBP, vous pouvez identifier et remonter les problèmes de non-conformité découverts lors d’un audit pour créer un plan de gestion des éléments d’action. Les avantages sont percutants. Dans un autre exemple, dans un processus de production, les anomalies peuvent être identifiées au stade de la conception, ce qui permet d’économiser des dépenses importantes par rapport à celles résolues plus loin dans le processus de fabrication ou même de distribution ou de faire son chemin dans les ventes aux consommateurs.
La mise en œuvre et la surveillance des non-conformités et l’efficacité de chacune pour éviter les opérations d’affaires défavorables sont rendues possibles grâce à eQMS. Avec un eQMS, chaque incident sera enregistré avec tous les éléments d’action associés suivis.
Principales caractéristiques:
- Identification de la cause profonde, raison principale de la NC ou de ce qui s’est mal passé
- Pourquoi le travail ne répond pas aux spécifications
- Que peut-on faire pour éviter que le problème ne se reproduise
- Explication des mesures correctives prises ou à prendre
- Personnes clés impliquées dans le NC et spécifications concernées par le NC
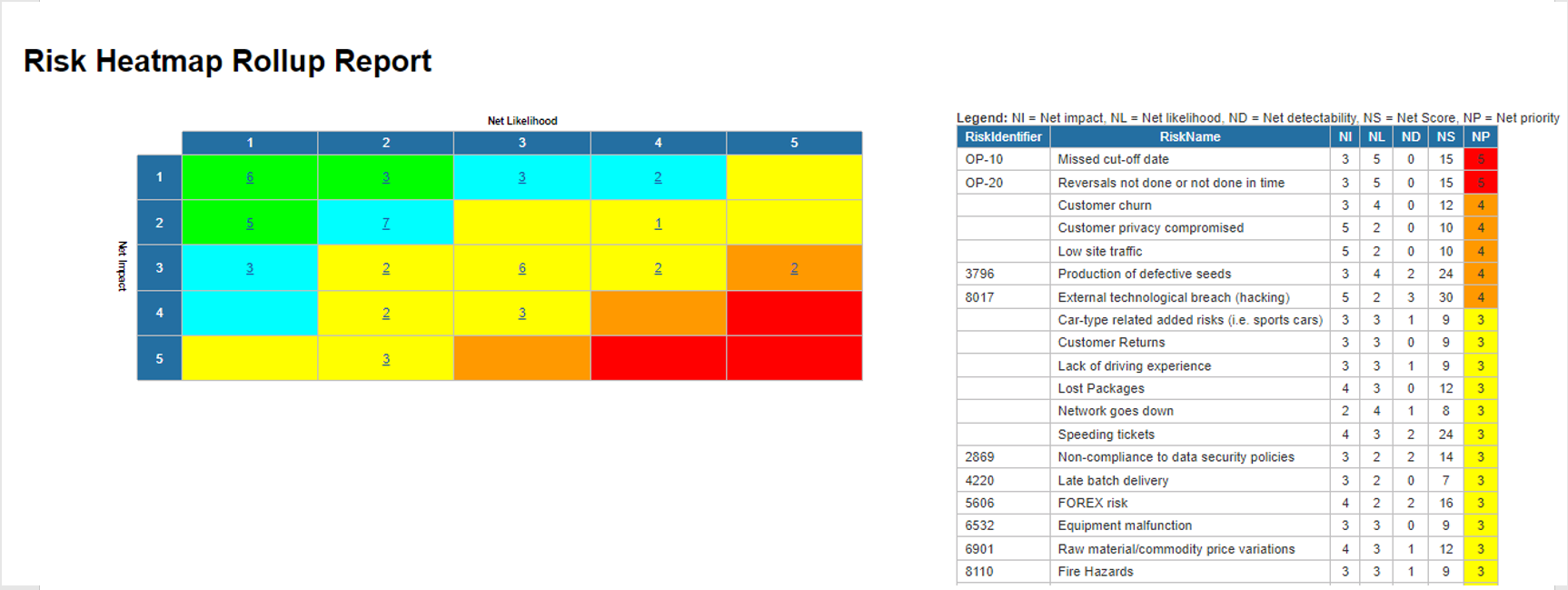
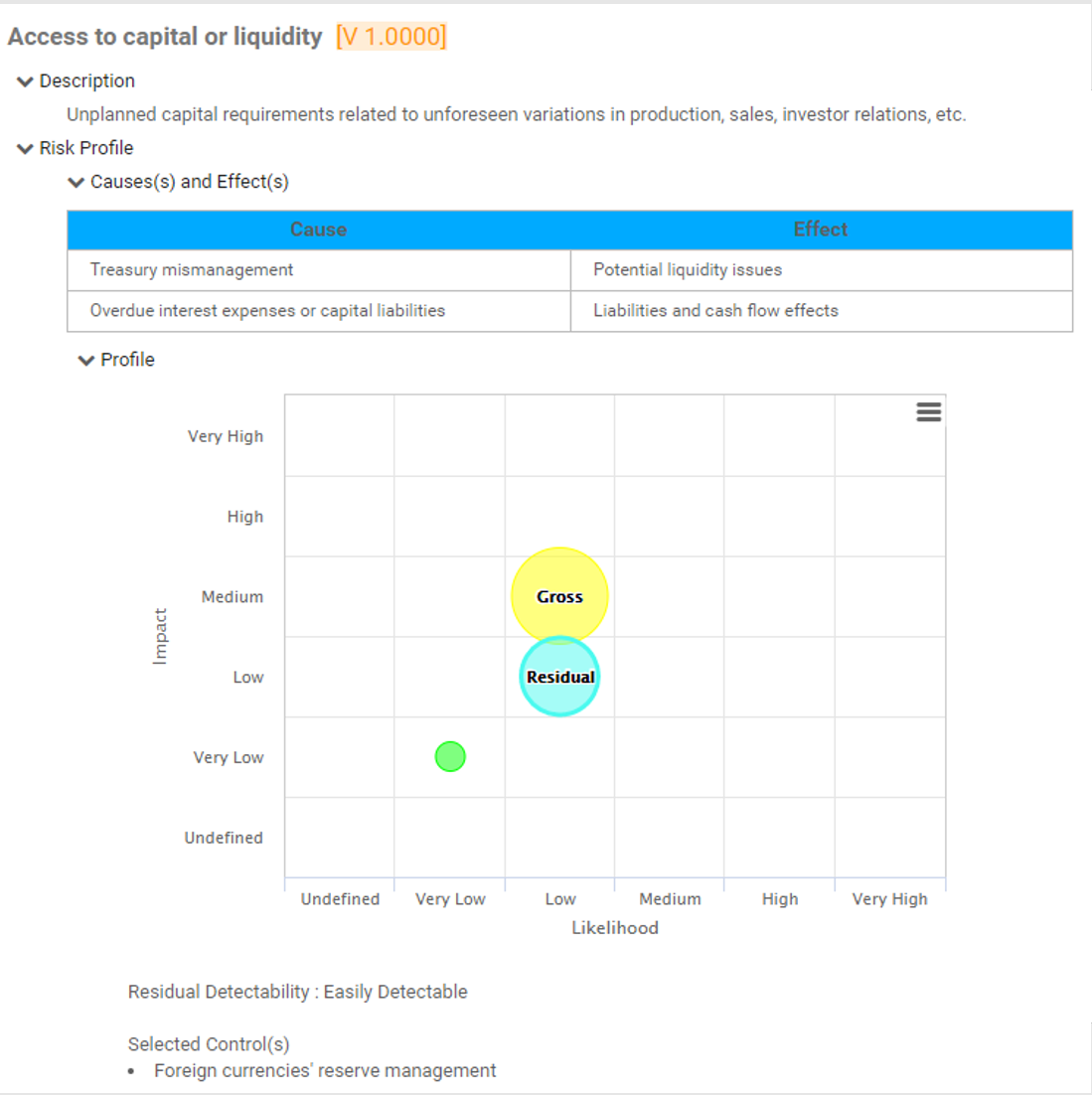
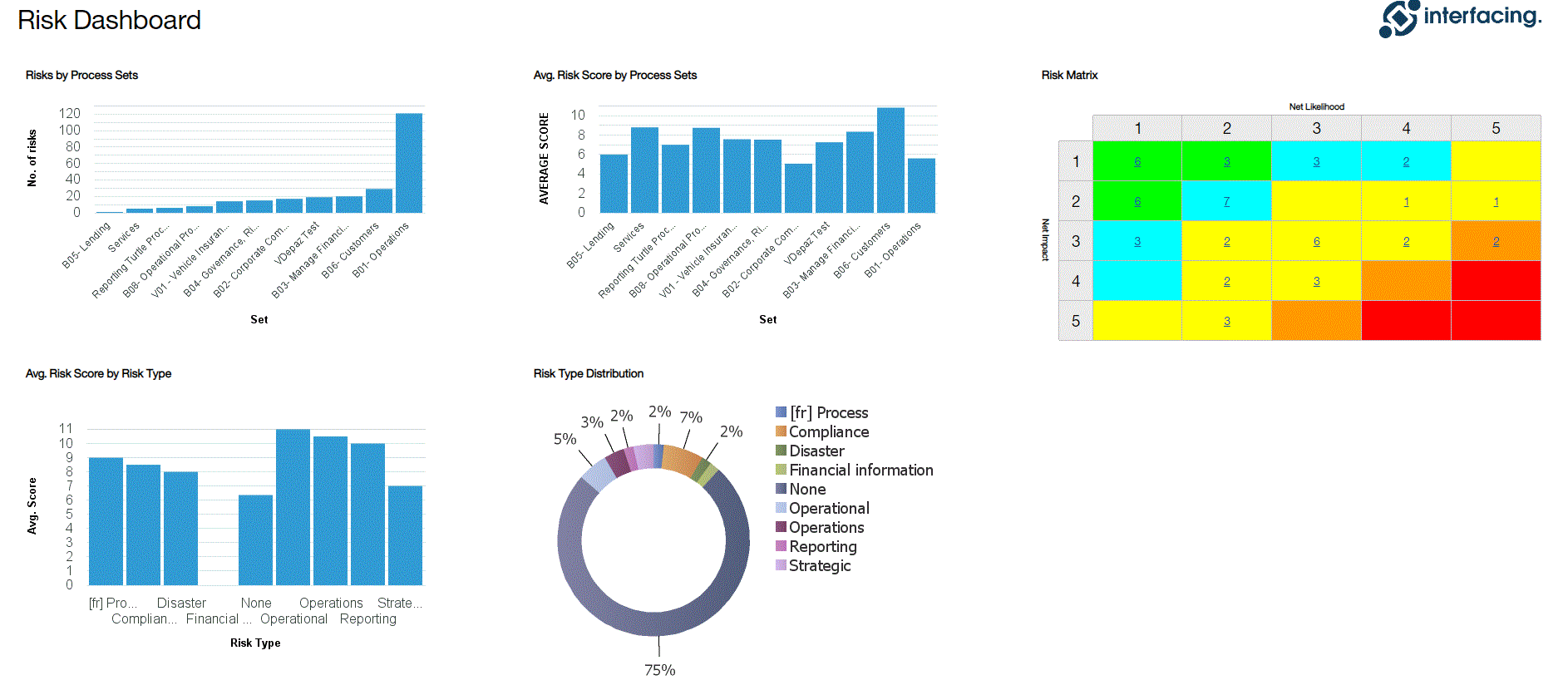
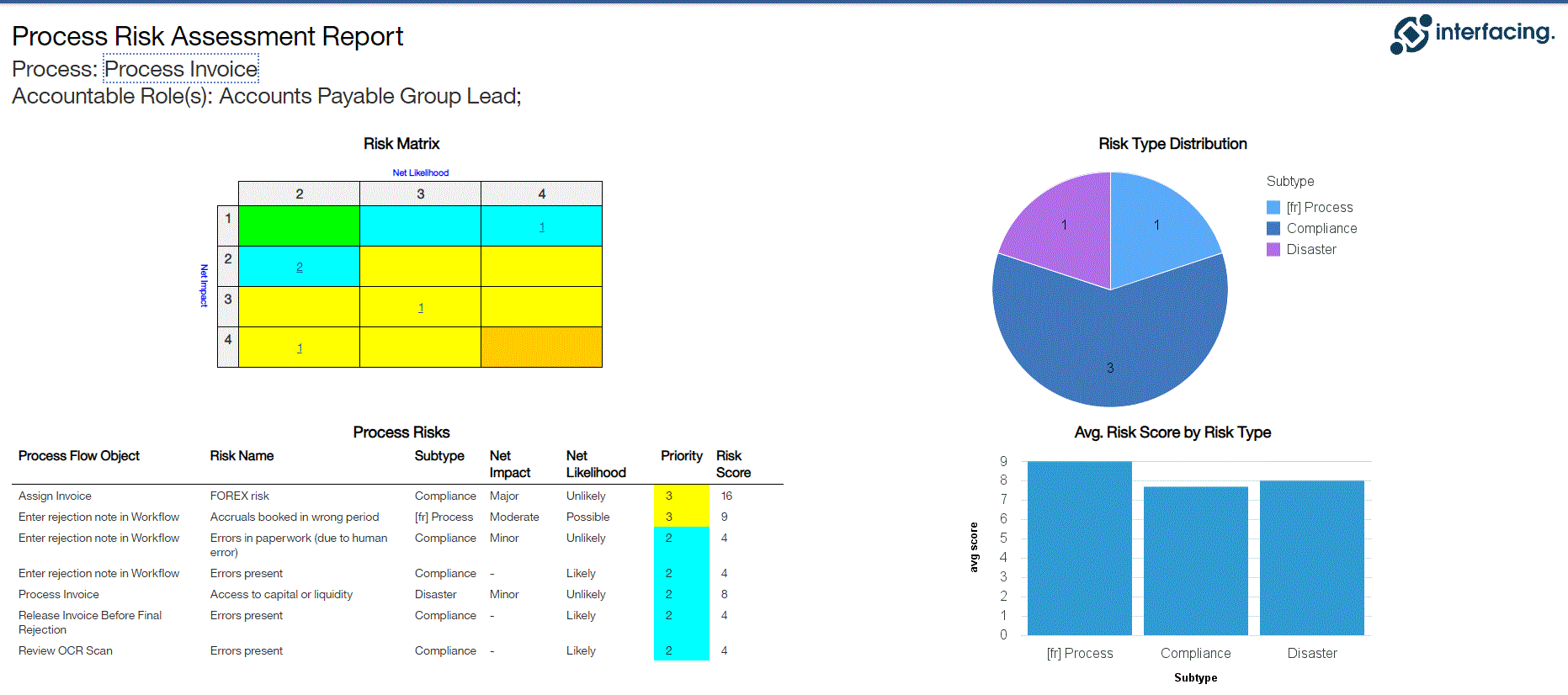
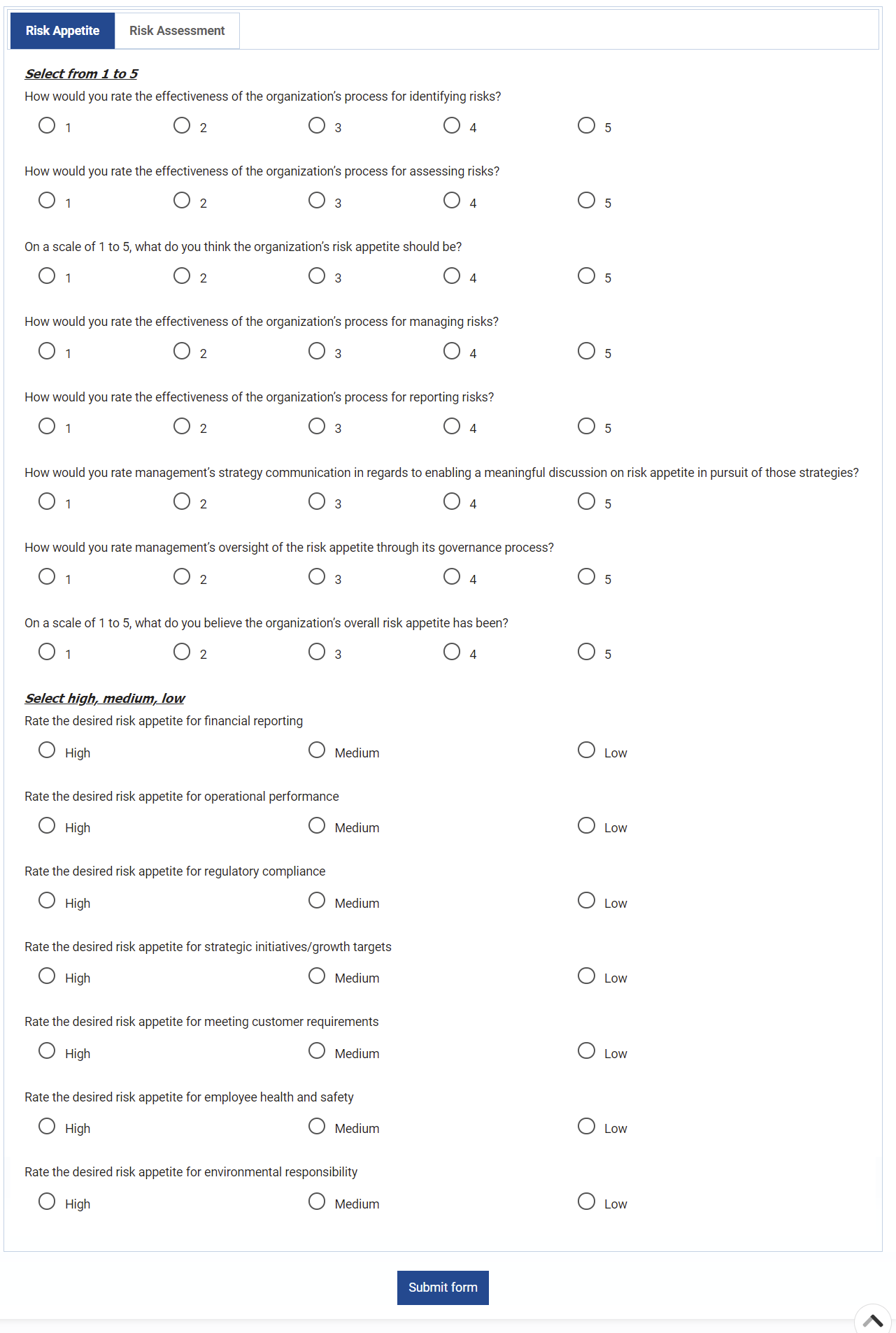
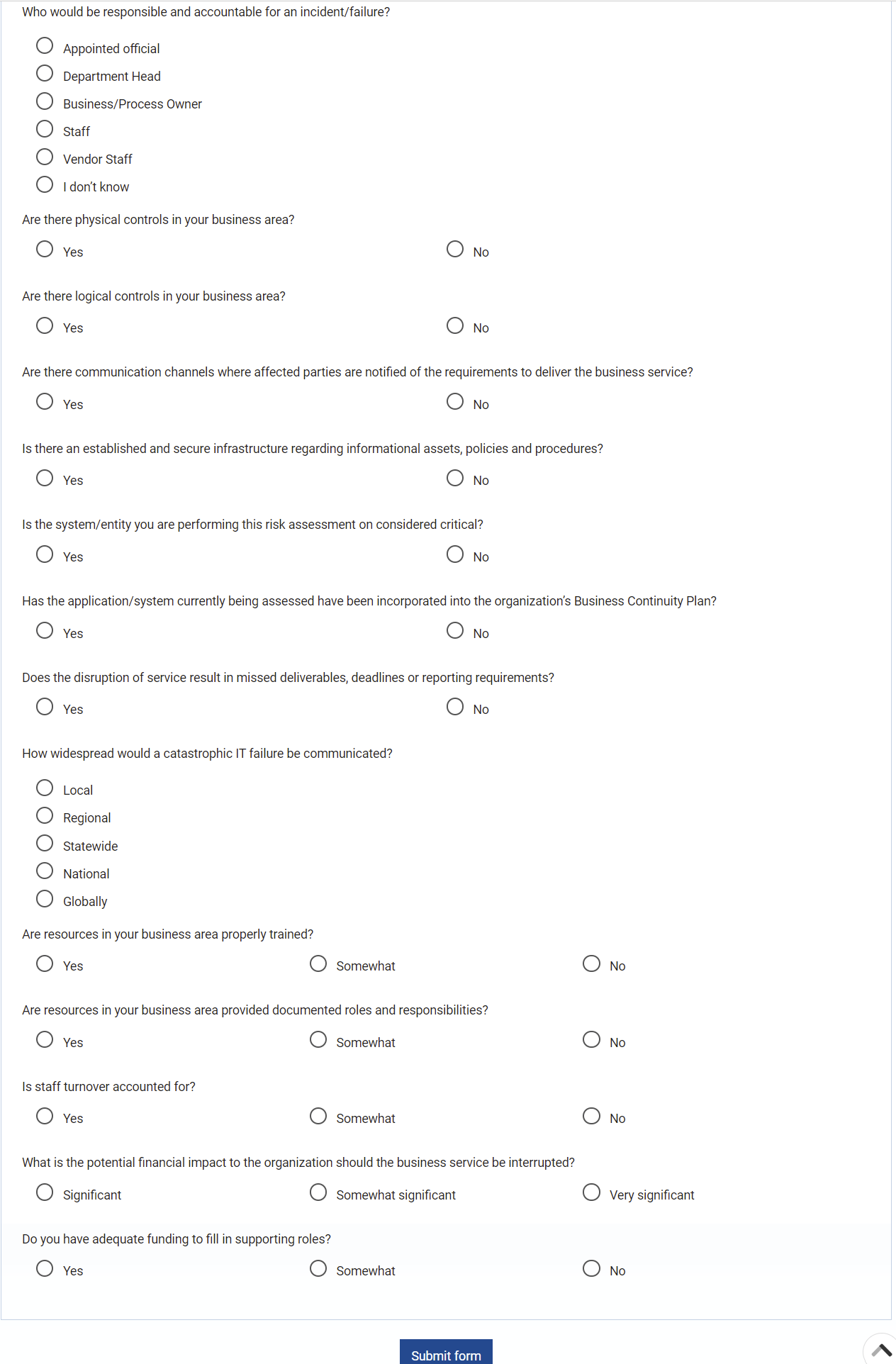
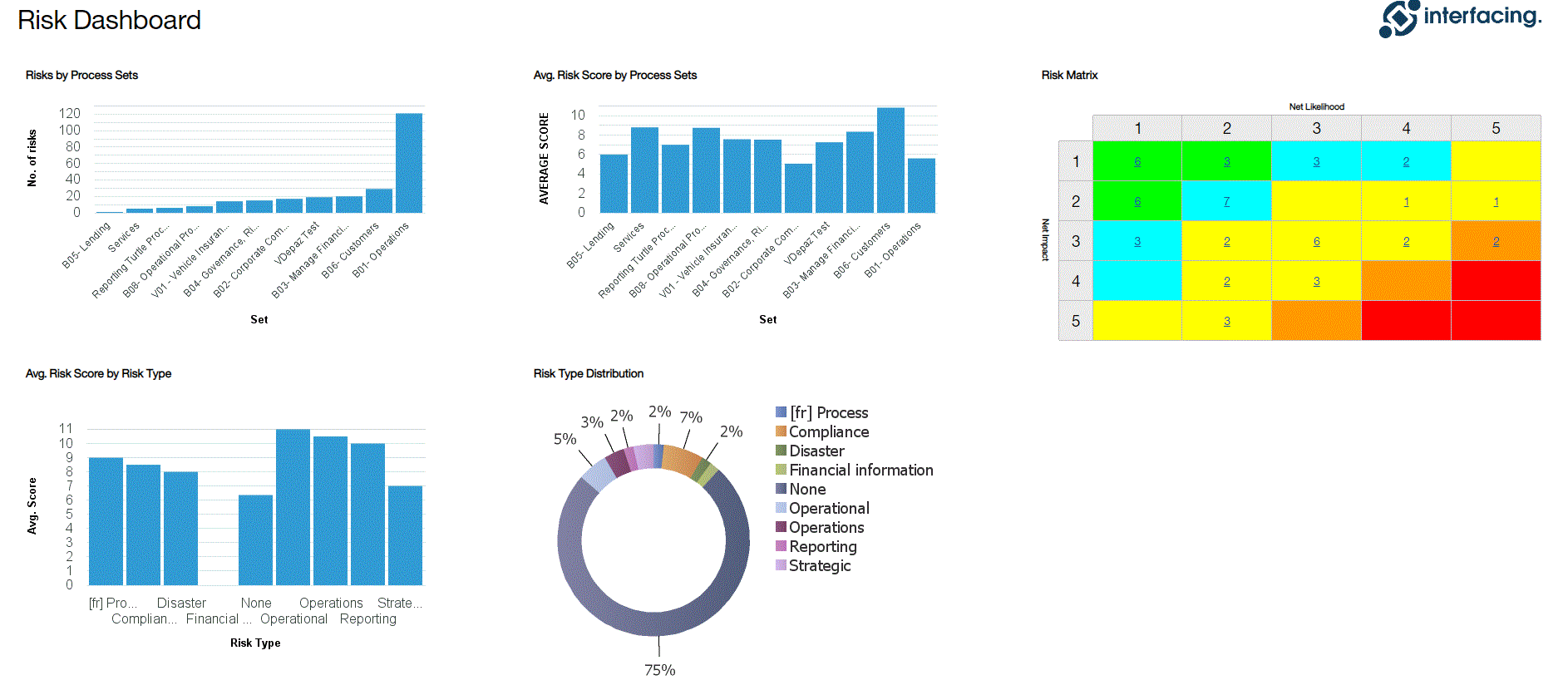
Gestion des risques
Enterprise Process Center® (EPC) permet aux organisations d’être proactives plutôt que réactives en matière de contrôle des risques et de stratégies de gestion des risques de processus. Non seulement la gestion des risques est importante pour se protéger contre les catastrophes, mais en intégrant des contrôles dans les opérations quotidiennes, vous pouvez vous assurer que les normes de qualité sont respectées et que la satisfaction des clients est maintenue. De plus, il n’y a rien de plus que le coût de la “non-conformité”, par conséquent, une transparence complète des risques et des processus est une nécessité pour se conformer aux lois et aux exigences réglementaires telles que Sarbanes Oxley, Bâle III, FMI, HIPAA, FDA, ISO 15000, entre autres.
Principales caractéristiques:
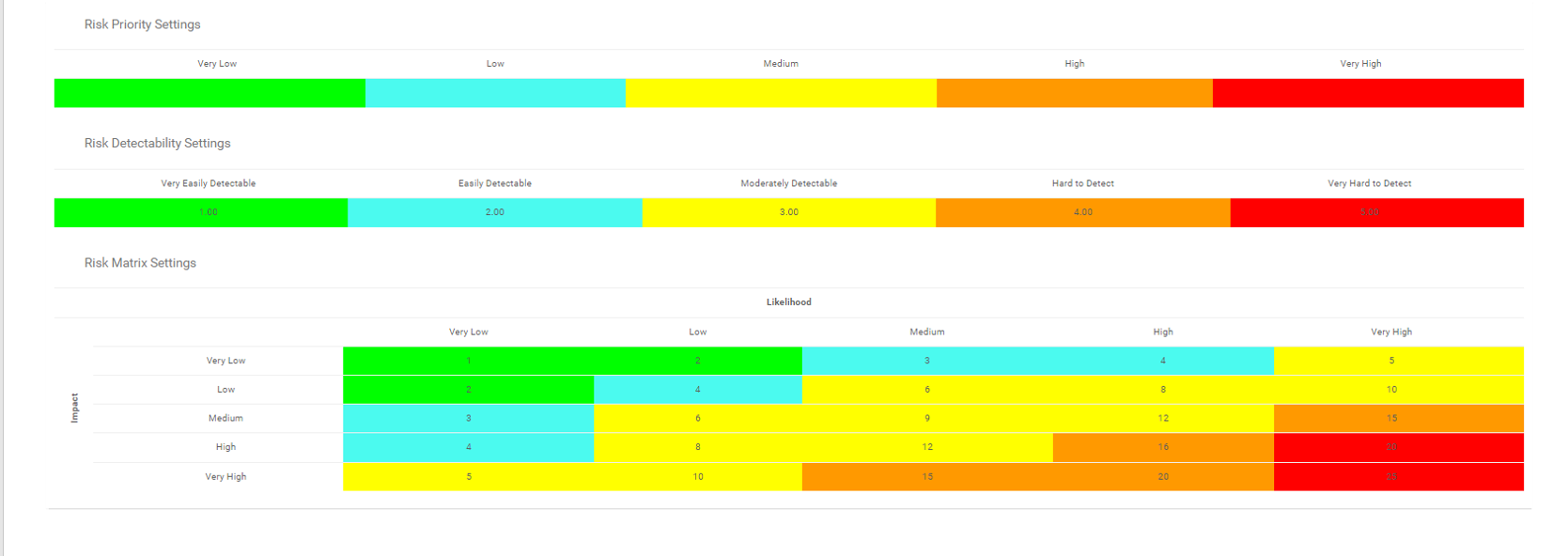
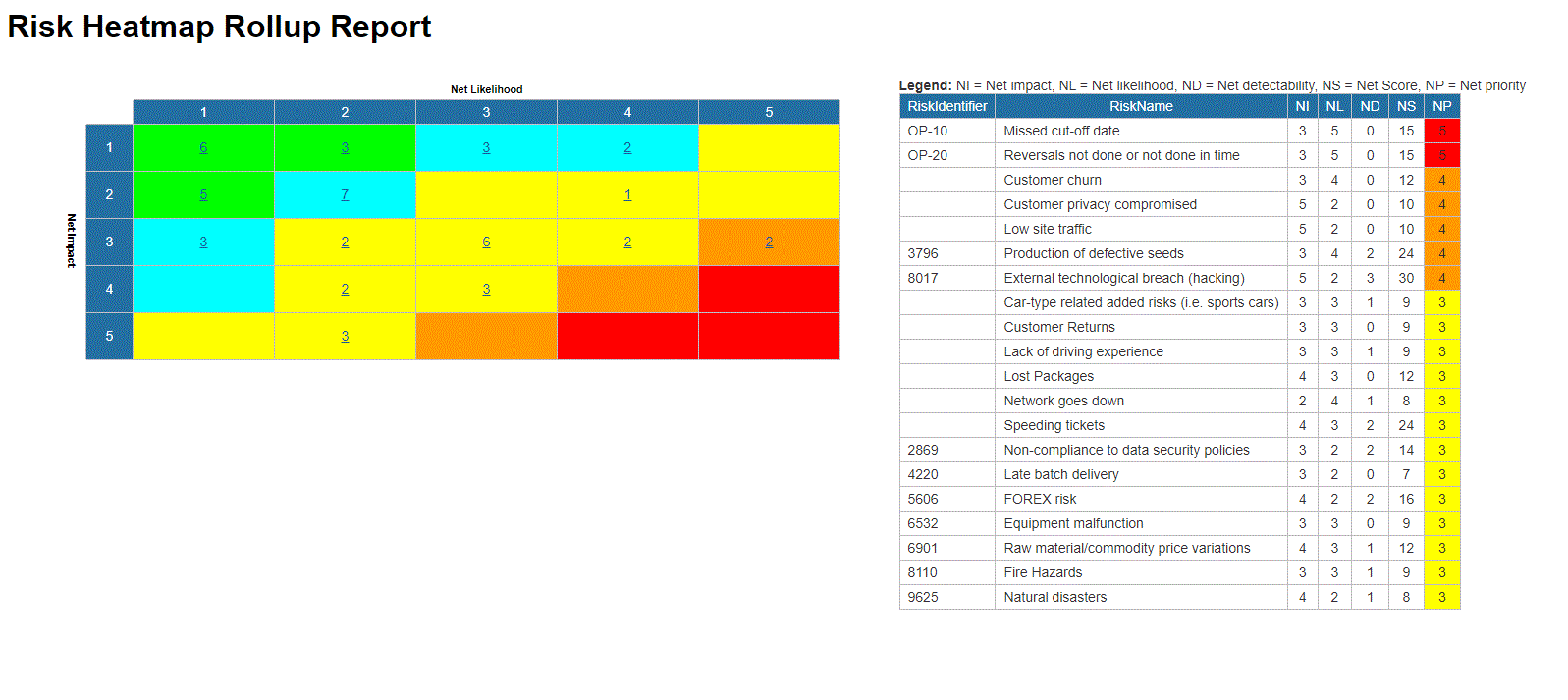
- Bibliothèque détaillée des risques incluant identifiant, description, type, catégorie, ressources responsables (via RASCI-VS)
- Matrices de risque personnalisables comprenant la probabilité de risque, l’impact, le score, le pourcentage, la couleur et la priorité
- Importer/exporter les détails des risques via Excel
- Visibilité de bout en bout des processus associés aux risques
- Filtrer, rechercher et signaler les risques par attributs
- Risques et contrôles réutilisables
- Déclencher CAPA en fonction de l’analyse des risques liés aux processus et aux tâches
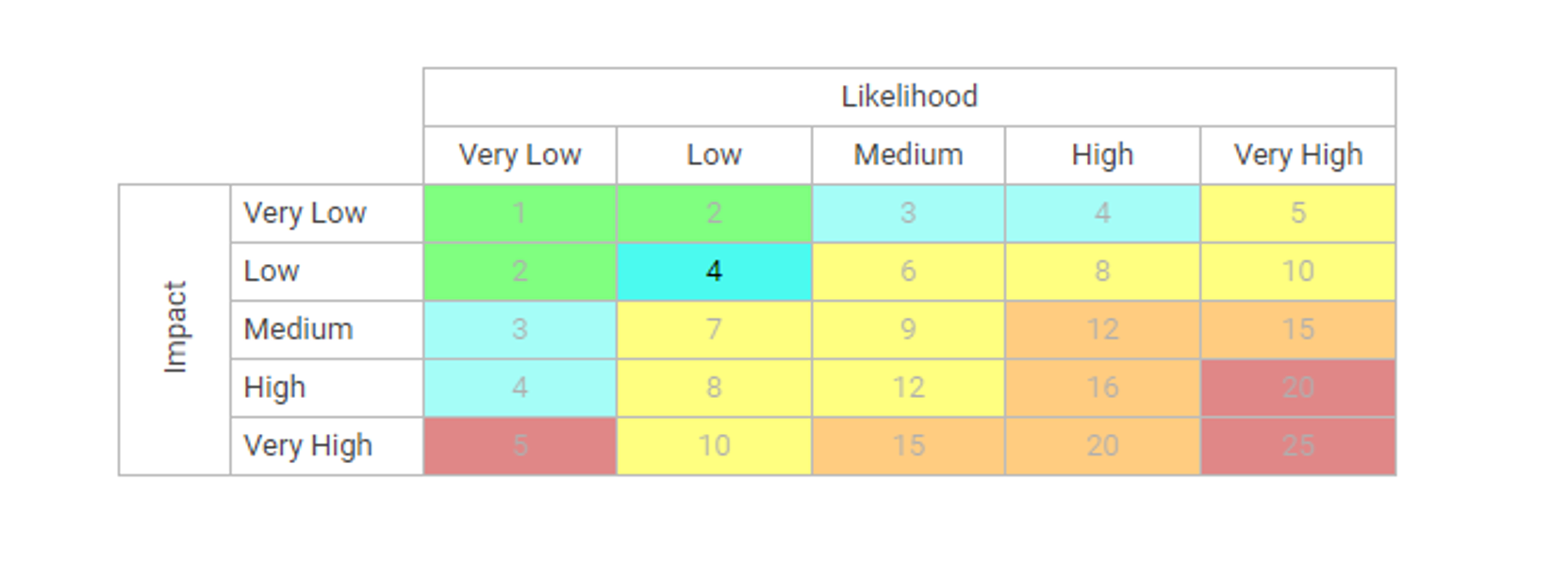
Visualisez la cause et l’effet des risques pour suivre les informations critiques sur les risques ; les gestionnaires de risques analysent et priorisent l’atténuation des risques
Édition étendue des risques (risque brut par processus, risque net par contrôle sur processus, contrôles spécifiques par processus, calcul de cumul de dérogation par processus)
Détecter la survenance d’un risque ; algorithme automatisé de cumul des risques pour la notation des risques
Le risque résiduel offre une vision réaliste de l’impact potentiel
La matrice des risques visualise 5 niveaux différents de risques résidant dans les processus
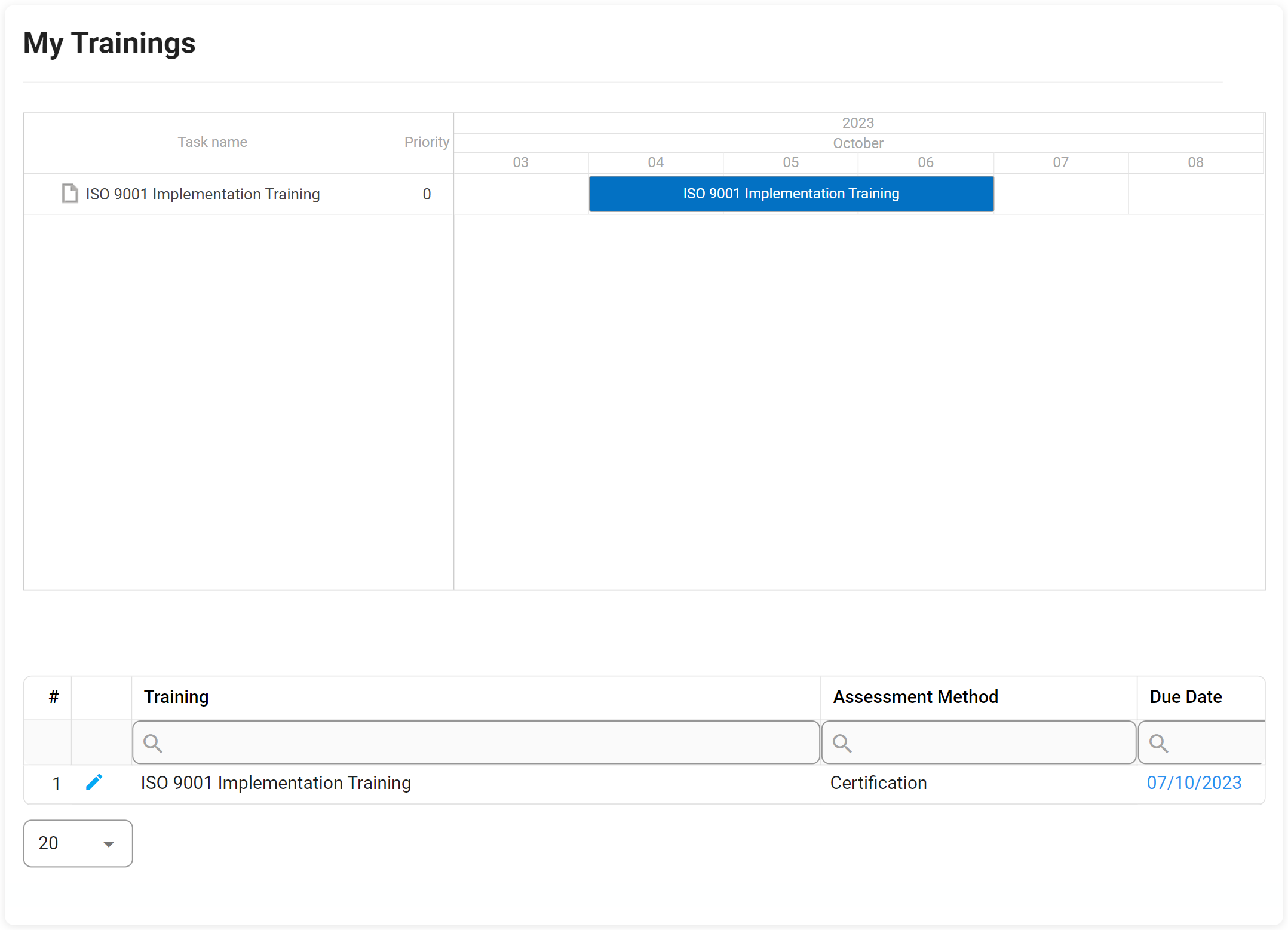
Gestion de formation
Le défi d’aujourd’hui en matière de formation consiste en fait à gérer la quantité et la fréquence des formations dispensées dans les opérations de l’entreprise. Ce défi a le plus d’impact sur le suivi singulier d’un employé spécifique. Digital Business Platform d’Interfacing prend en charge la gestion de la formation de votre entreprise grâce à sa capacité à se connecter sans effort à tous les systèmes de gestion de l’apprentissage (LMS) au sein de l’organisation.
Mesurez l’efficacité de la formation à l’aide de questionnaires contrôlés ou de quiz après une session de formation terminée pour vous assurer que votre programme de gestion de la formation répond aux exigences réglementaires et atteint avec succès le seuil élevé de connaissances institutionnelles de votre organisation.
Cela donne aux administrateurs de formation une visibilité sur toutes les plateformes de formation liées aux exigences réglementaires, aux processus, aux documents et à la formation elle-même. Considérez-le comme un référentiel central pour surveiller et suivre toutes les formations.
Principales caractéristiques:
- Définir des questionnaires personnalisés pour le pré / post formation pour mesurer l’efficacité
- Tirez parti des questionnaires standard pour créer rapidement de nouveaux modèles de formation
- Fournir un lien direct vers les supports de formation
- Réutiliser les exigences de conformité documentées du référentiel IMS (Réglementation, Documents, Processus)
- Attribuer une formation dynamiquement
- Fournir aux utilisateurs une vue calendrier / Gantt de leurs formations
- Fournir aux instructeurs une vue de leurs cours
- Désactiver l’entraînement après utilisation
- Demander une prolongation de formation
- Les gestionnaires doivent approuver la formation après l’achèvement
Pilotage du Contrôle : Audit, Analyse & Reporting des Indicateurs de Risque,
EPC offre au sein d’une plate-forme collaborative unique un espace où les analystes peuvent identifier, évaluer et hiérarchiser les plans d’atténuation des risques, et les auditeurs peuvent planifier puis exécuter des audits de contrôle et mettre en œuvre des plans d’action correctifs basés sur les résultats des tests. Par ailleurs, en identifiant les principaux indicateurs de risque et de contrôle et en quantifiant les seuils ; la direction peut surveiller les mesures pour s’assurer que les politiques sont appliquées et que les normes sont maintenues.
Principales caractéristiques:
- Surveiller les contrôles par le biais d’audits
- Planification des audits récurrents
- Mettre en œuvre des CAPA basés sur les résultats des tests
- Cadre COSO Cube ERM
- Analyse générale, analyse du chemin critique et analyse du chemin à haut risque générées de manière dynamique
- Rapport sur les contrôles généraux et les risques & rapport personnalisé
- Indicateurs clés de risque et de contrôle réutilisables (KRI, KCI) pour plusieurs sources
- Définition du seuil cible pour l’amélioration continue
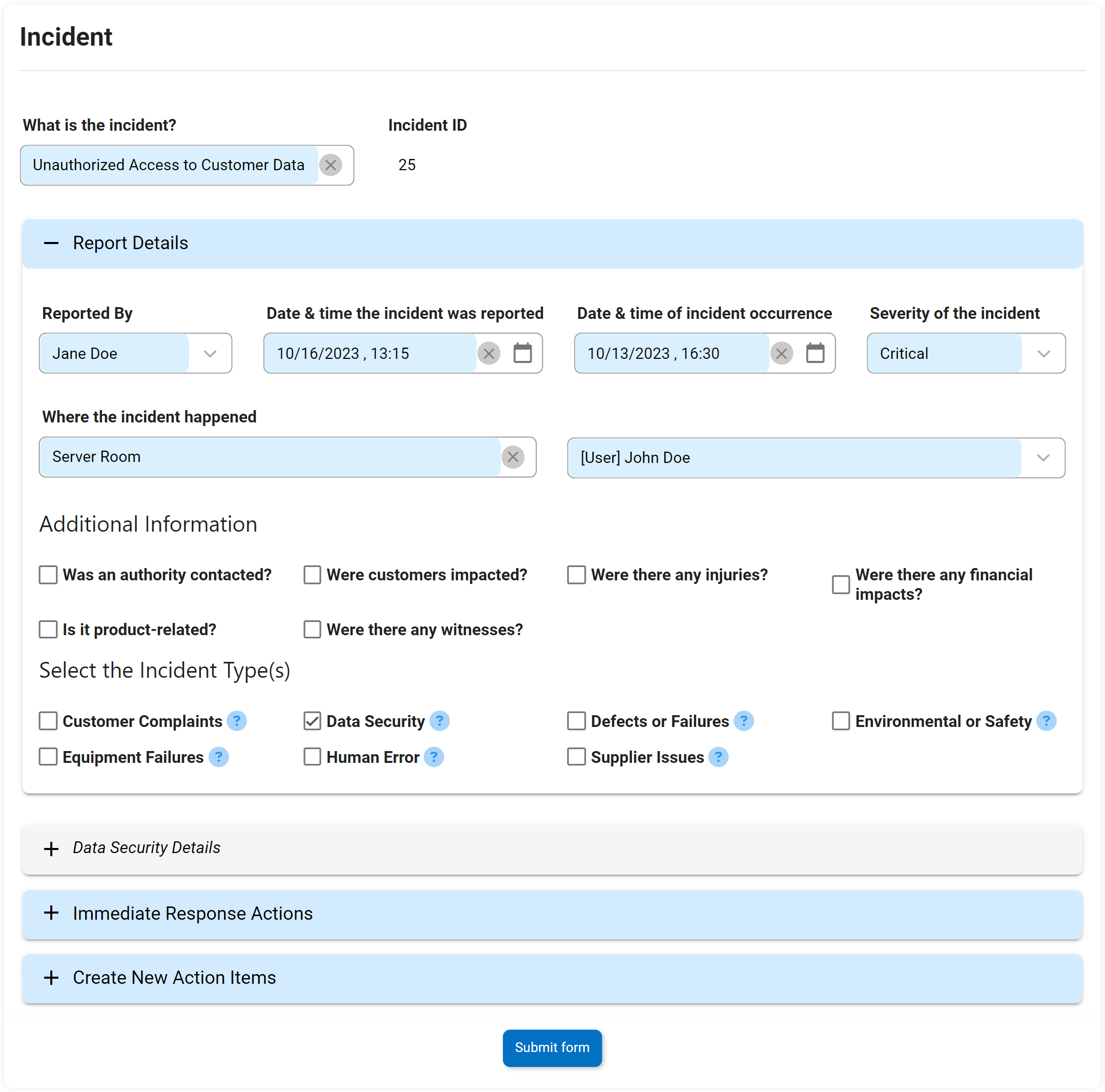
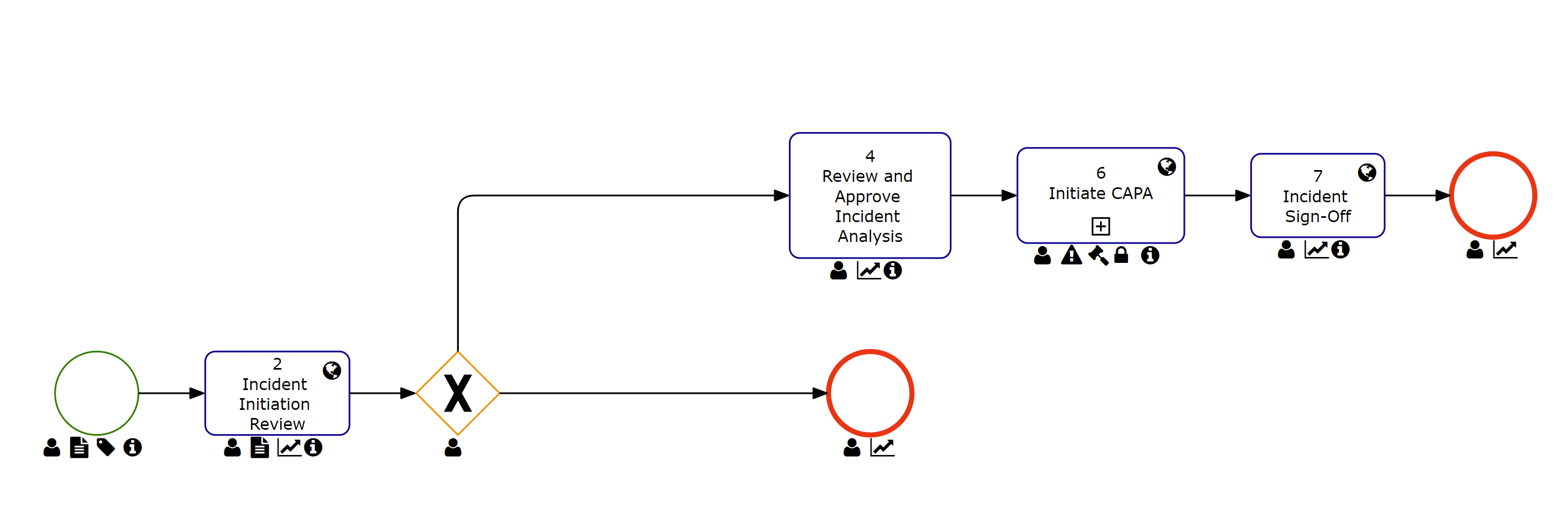
Gestion des incidents
Les procédures et les actions prises pour répondre et résoudre les incidents qui se produisent sont connues sous le nom de gestion des incidents. Le DBP d’Interfacing prendra en charge ces actions en suivant et en intensifiant les mesures correctives du début à la fin. DBP effectuera une analyse des causes profondes (RCA) et une analyse des incidents.
Une solution Digital Business Platform garantit que tous les incidents sont traités rapidement et que des normes de qualité élevées sont maintenues. Les équipes bénéficient également d’améliorations des opérations, empêchant la répétition d’incidents futurs.
Principales caractéristiques:
- Réutiliser les informations des étapes précédentes d’un processus d’incident
- Effectuer une analyse des causes profondes et une analyse des risques
- Définissez plusieurs cycles de révision et cycles d’approbation
- Déclencher une escalade vers CAPA si nécessaire
- Suivre l’incident avec le code de suivi à n’importe quelle étape du processus
- Rapports d’incident avec des détails détaillés pour afficher des sous-ensembles d’informations relatives
- Enquête sur les incidents avec confirmation d’achèvement par signature électronique
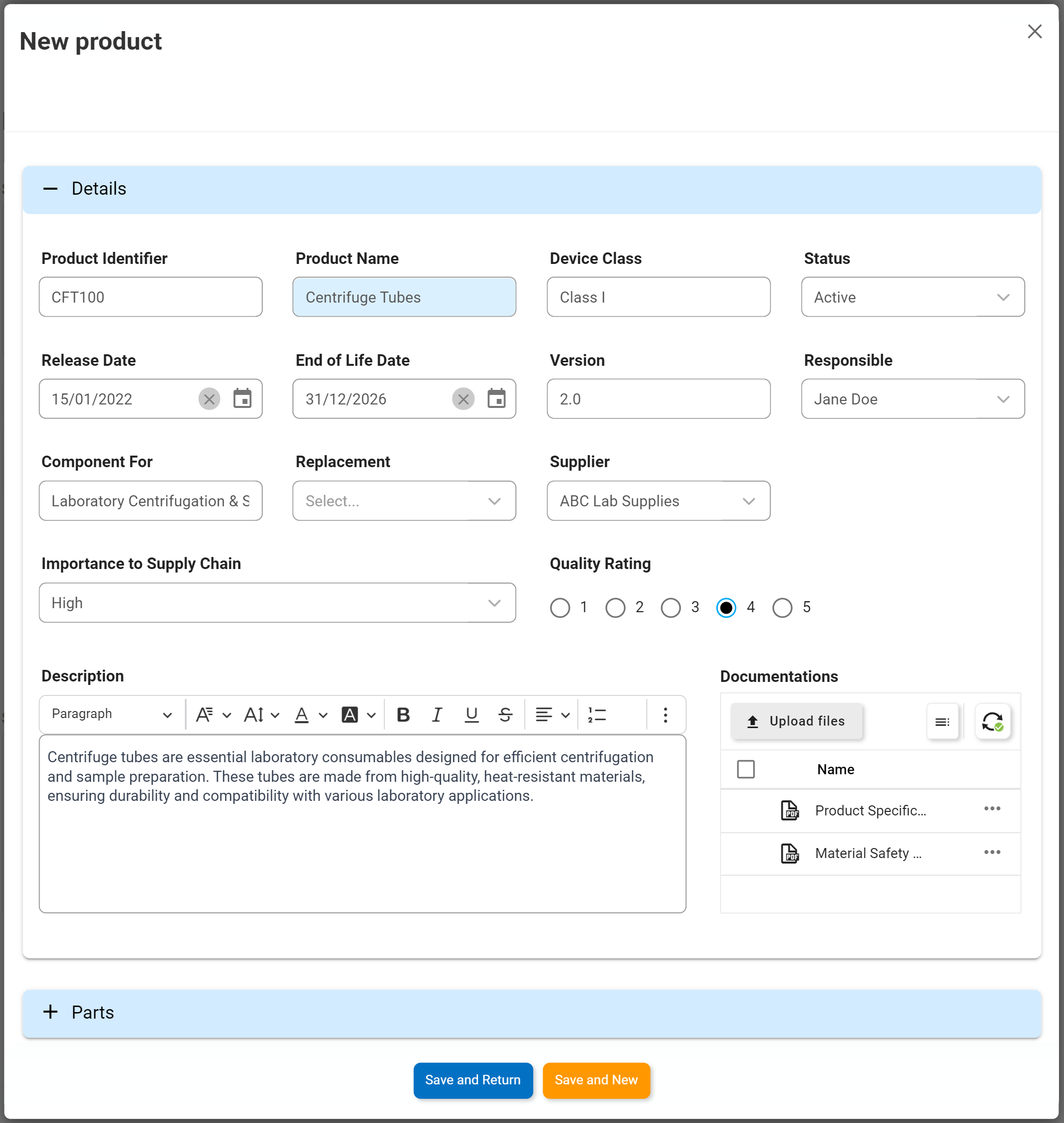
Gestion des fournisseurs et des produits / SCAR
Principales caractéristiques:
- Effectuer une analyse des causes profondes (RCA)
- Tirer parti des meilleures pratiques Méthodologies des causes profondes (5Ws, Analyse comparative, 3×5 Why)
- La cause première est intégrée dans le flux de travail
- Envoyez directement des tâches aux utilisateurs dans le cadre du flux de travail SCAR
- Soulever des points d’action sur les fournisseurs (SCAR)
- Réutiliser les informations fournisseurs gérées de manière centralisée
- Informer directement le fournisseur
- Afficher/modifier/ajouter plusieurs éléments d’action SCAR
- Rôles responsables et état des éléments d’action disponibles en temps réel
eQMS et conformité
Nous comprenons que les exigences imposées aux organisations en termes de conformité sont très élevées et que les normes ISO9000, ISO13845, ISO17025, ISO27001, SOC 2, FDA QSR et GxP constituent une partie essentielle de ce programme. En utilisant nos solutions, votre entreprise acquiert la responsabilité et la cohérence qui vous donneront une longueur d’avance sur vos concurrents. Nos outils garantissent une visibilité totale de bout en bout, de la création et de la modification d’un règlement à l’approbation et à la révision du contenu en passant par la mise à jour et le recyclage des employés aux procédures opérationnelles normalisées (SOP). Nous considérons la gestion complète du cycle de vie comme des éléments mobiles d’un écosystème complet et c’est pourquoi cette approche unique combine les exigences réglementaires, les documents, les processus, les instructions de travail et la gouvernance.
Norme internationale qui spécifie les exigences pour un SMQ. Il s'agit de la norme la plus populaire de la série ISO 9000 et de la seule norme de la série à laquelle les organisations peuvent se certifier.
Publié pour la première fois en 1987 par l'Organisation internationale de normalisation (ISO). La version actuelle d'ISO 9001 a été publiée en septembre 2015.
En bref, ISO 13485 est une norme internationalement reconnue que les pays suivants ont adoptée : Europe, Canada, Australie et autres marchés. À l'exception du Canada, l'application de la norme ISO 13485 n'est pas une exigence, mais est la norme de facto utilisée aujourd'hui comme mesure de la conformité totale au SMQ énoncée dans les règlements sur les dispositifs médicaux.
L'ISO/CEI 17025 définit les exigences générales de compétence en matière d'essais et d'étalonnage pour tous les laboratoires. Pour les laboratoires d'essais et d'étalonnage, il s'agit de la norme ISO définitive.
À de nombreuses occasions, les autorités réglementaires et les fournisseurs n'accepteront pas les résultats de test ou d'étalonnage d'un laboratoire qui fonctionne indépendamment de toute surveillance d'accréditation. C'est là qu'ISO/IEC 17025 (initialement connu sous le nom d'ISO/ISO/IEC 17025 Guide 25) entre en jeu.
ISO 27000 est une série de normes conçues pour protéger les actifs d’information des organisations. ISO 27000 donne également un aperçu d’un système de gestion de la sécurité de l’information (ISME),définissant et décrivant l’ensemble logiquement organisé de processus qui guident les organisations à aligner leurs objectifs d'affaire sur leur sécurité de l’information.
Moins connue sous le nom de version plus longue, "Systems and Organizations Controls 2", SOC 2 (ou SOC II) est un cadre utilisé pour aider les entreprises à démontrer les contrôles de sécurité qui sont en place pour protéger les données des clients dans le cloud. Ces contrôles sont devenus connus sous le nom de Trust Services Principes : sécurité, disponibilité, intégrité du traitement, confidentialité et enfin confidentialité .
D'autres pays auront leurs propres critères pour répondre aux exigences nuancées du SMQ. Par exemple, bien que le Brésil et le Japon aient leurs propres exigences, ils sont tous deux basés sur les normes QSR de la FDA des États-Unis et ISO 13485.
Sur une note positive, ces normes répondent aux exigences de gestion de la qualité harmonisées pour répondre aux normes américaines, canadiennes, européennes et à toutes les autres normes QMS en vigueur.
Le QSR de la FDA des États-Unis (également connu sous le nom de 21 CFR Part 820) a été introduit avant la norme ISO 13485. Toutes les sociétés de dispositifs médicaux aux États-Unis sont tenues de respecter cette norme pour la distribution nationale, mais doivent se conformer aux deux réglementations afin de distribuer des dispositifs à l'échelle internationale. Le QSR de la FDA des États-Unis doit également être respecté par les entreprises internationales qui souhaitent faire des affaires avec des clients américains.
Dans le cadre de notre engagement continu envers la conformité et en veillant à ce que nos clients répondent à leurs exigences réglementaires, nous sommes toujours à la recherche de moyens d’aider nos clients à atteindre et à maintenir la pleine conformité. L'interface est certifiée ISO 27001 et nous nous associons à Amazon Web Services (AWS) pour l'hébergement dans le cloud, car leur engagement en matière de conformité est prouvé, avec la conformité des centres de données mondiaux à SOC 1 Type II et ISO 27001. Pour plus d'informations sur la conformité AWS pour ISO 18345, FDA QSR et GxP, veuillez vous référer à leur programme de conformité .
Pourquoi Interfacing?
Éliminez le fardeau de la conformité et améliorez la qualité des produits en automatisant les processus qualité critiques tels que la gestion des documents, des événements qualité, de la formation, de la chaîne de valeur et des audits dans une seule solution de bout en bout Enterprise Process Center EQMS.
Pour en savoir plus ou discuter de la manière dont Interfacing peut aider votre organisation, veuillez remplir le formulaire ci-dessous.
Sciences de la vie et pharmaceutique
En adoptant une culture forte et centrée sur les processus, votre entreprise peut passer en douceur de systèmes de gestion chaotiques et ad hoc à une opération conforme à la réglementation .
QMS de la technologie des dispositifs médicaux
Chaque aspect du processus de technologie médicale doit être contrôlé et surveillé conformément aux exigences ISO 13845 et US FDA QSR. En savoir plus ici .
Gagnez en transparence avec Enterprise Process Center®
Le logiciel Digital Twin Organization d’Interfacing fournit la transparence et la gouvernance pour améliorer la qualité, l’efficacité et assurer la conformité réglementaire.
Lisez nos blogs
Prenez un moment pour lire les blogs sur GXP, la conformité réglementaire, les tendances actuelles et bien plus encore!
Découvrez comment votre organisation peut bénéficier d’une solution eQMS d’Interfacing.
L’un des principaux facteurs de différenciation d’Interfacing par rapport aux autres sociétés de conseil en transformation numérique et d’affaire est qu’Interfacing propose sa propre solution technologique innovante pour soutenir les programmes de transformation.
Les solutions soutenues par l’eQMS offrent la transparence nécessaire pour réduire la complexité, améliorer l’exécution et faciliter l’agilité et le changement.
Le système de gestion intégrée eQMS d’Interfacing est un guichet unique pour la gestion des programmes de transformation. Nous savons que c’est un environnement très concurrentiel. C’est pour cette raison que notre force réside dans notre engagement à maintenir la flexibilité tout au long du cycle de vie du projet que ce soit dans nos produits innovants ou dans notre équipe d’experts.